名校
解题方法
1 . 向一定量的Fe、Fe2O3和CuO混合物投入100mL 0.9mol/L的硫酸溶液中,充分反应后生成448mL标准状况下的气体,得不溶物0.03mol。向滤液中加入2mol/L的NaOH溶液,加至10mL时开始出现沉淀。忽略溶液的体积变化,下列说法不正确的
| A.0.03mol不溶物全为Cu | B.混合物中氧原子的物质的量为0.05mol |
| C.滤液中的阳离子只有两种 | D.滤液中的Fe2+的物质的量浓度为0.8mol/L |
您最近一年使用:0次
2021-02-02更新
|
1429次组卷
|
8卷引用:专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测
(已下线)专题讲座(一) 化学计算的常用方法(精练)-2022年高考化学一轮复习讲练测湖北省沙市中学2020-2021学年高一上学期期末考试化学试题(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)江西省景德镇一中2022-2023学年高一上学期期中考试(19班)化学试题湖北省武汉市第六中学2021-2022学年高一上学期12月月考化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题福建师范大学附属中学2021-2022学年高一下学期期末考试化学试题
解题方法
2 . 下列物质反应后一定有+3价铁生成的是
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应;③FeCl2溶液中通入少量Cl2;④Fe和Fe2O3的混合物溶于盐酸中
①过量的Fe与Cl2反应;②Fe与过量稀硫酸反应;③FeCl2溶液中通入少量Cl2;④Fe和Fe2O3的混合物溶于盐酸中
| A.只有① | B.①③ |
| C.①②③ | D.①③④ |
您最近一年使用:0次
解题方法
3 . 铋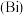 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是

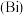 与氮同主族,在中性及碱性环境下常以
与氮同主族,在中性及碱性环境下常以 的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为
的形式存在,铋及其化合物广泛应用于电子、医药等领域。以辉铋矿(主要成分为 ,含少量杂质
,含少量杂质 等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
等)为原料,采用湿法治金制备精铋工艺流程如下,下列说法错误的是
A.“浸出”产生S的主要离子反应为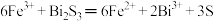 |
| B.“浸出”时盐酸可以还原杂质PbO2 |
| C.“浸出、置换、再生、电解精炼”工序中不全是氧化还原反应 |
| D.再生液可以加入“浸出”操作中循环利用 |
您最近一年使用:0次
2020-12-15更新
|
677次组卷
|
4卷引用:押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)
(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)广东省2021届高三“六校联盟”第二次联考化学试卷湖南省岳阳市2021届高三二模考试化学试题江苏省(天一中学.海门中学.姜堰中学.淮阴中学)四校2021届高三4月联考化学试题
2014·湖南长沙·二模
名校
4 . 在混合体系中,确认化学反应先后顺序有利于解决问题,下列反应先后顺序判断正确的是( )
| A.在含FeBr2、FeI2的溶液中缓慢通入Cl2:I-,Br-,Fe2+ |
| B.在含Fe3+,Cu2+、H+的溶液中加入Zn:Fe3+,Cu2+、H+、Fe2+ |
| C.在含Ba(OH)2、KOH的溶液中通入CO2:KOH,Ba(OH)2,BaCO3、K2CO3 |
D.在含[Al(OH)4]-、OH-,CO 溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO 溶液中,逐滴加入盐酸:[Al(OH)4]-、Al(OH)3、OH-、CO |
您最近一年使用:0次
2020-12-07更新
|
236次组卷
|
25卷引用:黄金30题系列 高三化学 小题易丢分
(已下线)黄金30题系列 高三化学 小题易丢分(已下线)考点04 离子反应——备战2019年浙江新高考化学考点(已下线)2013-2014湖南省长沙市高三高考二模理综化学试卷2016届湖南省长沙市雅礼中学高三上学期月考化学试卷2016届重庆市万州第二高级中学高三11月月考理科综合化学试卷2016届江西省宜春市丰城中学高三上学期第四次月考化学试卷2017届河北省唐山一中高三上10月月考化学试卷2016-2017学年河北省武邑中学高二上学期期末考试化学试卷江西省抚州市临川区第一中学2018届高三上学期第一次月考化学试题福建省三明市第一中学2018届高三上学期期中考试化学试题黑龙江省哈尔滨师范大学附属中学2018届高三10月月考化学试题【全国百强校】黑龙江省哈尔滨师范大学附属中学2019届高三上学期开学考试化学试题河北省石家庄第二中学2019届高三上学期9月月考化学试题【全国百强校】山东省济南市历城第二中学2019届高三上学期11月月考理科综合化学试题安徽省定远重点中学2019届高三上学期第三次月考化学试题甘肃省武威第一中学2019届高三上学期期末考试化学试题江西省南昌市第十中学2020届高三上学期期中考试化学试题福建省厦门双十中学2018届高三期中考试化学试题(已下线)考点03 氧化还原反应-2020年【衔接教材·暑假作业】新高三一轮复习化学安徽省安庆市宜秀区白泽湖中学2021届高三上学期入学考试化学试题内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题江西省丰城市第九中学2020届高三上学期期中考试化学试题安徽省淮北市孙疃中学2020-2021学年高二上学期第一次月考化学(实验班)试题福建省泰宁第一中学2020届高三上学期第二次阶段考试化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题
名校
5 . 将少量 气体通入
气体通入 和
和 的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
 气体通入
气体通入 和
和 的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是A.该过程表明 有漂白性 有漂白性 | B.白色沉淀为 |
C.该实验表明 具有还原性 具有还原性 | D.反应后溶液酸性增强 |
您最近一年使用:0次
2020-10-07更新
|
1688次组卷
|
9卷引用:周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)高一必修第一册(苏教2019版)专题4 C 高考挑战区江西省丰城市第九中学(日新班)2021-2022学年高一下学期期末检测化学试题(已下线)专题01 硫及其化合物的性质及转化(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题(已下线)清单01 硫及其化合物的性质(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)猜想01 硫及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
名校
解题方法
6 . 下列说法正确的是( )
| A.加热蒸干氯化铁溶液最终得到FeCl3晶体 |
| B.氢氧化铁与HI溶液仅发生中和反应 |
| C.FeCl3、FeCl2和Fe(OH)3都可以通过化合反应制取 |
| D.配制FeSO4溶液时,加入稀盐酸抑制Fe2+水解,加入铁粉防止Fe2+被氧化 |
您最近一年使用:0次
2020-09-11更新
|
197次组卷
|
3卷引用:易错16 盐类水解规律及应用-备战2021年高考化学一轮复习易错题
(已下线)易错16 盐类水解规律及应用-备战2021年高考化学一轮复习易错题安徽省阜阳市阜南实验中学2020届高三下学期4月月考化学试题黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期第一次验收考试化学试题
解题方法
7 . 利用硫酸渣(主要含Fe2O3、FeO,杂质为Al2O3和SiO2等)生产铁基颜料铁黄(FeOOH)的制备流程如下:
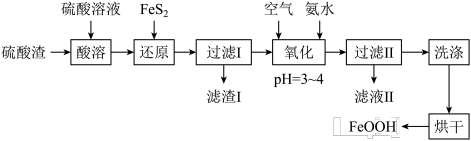
(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为___________________ 。
(2)滤渣I的主要成分是FeS2、S和___________ (填化学式);Fe3+被FeS2还原的离子方程式为_______________ 。
(3)“氧化”中,生成FeOOH的离子方程式为_______________ 。

(1)“酸溶”时,Fe2O3与硫酸反应的离子方程式为
(2)滤渣I的主要成分是FeS2、S和
(3)“氧化”中,生成FeOOH的离子方程式为
您最近一年使用:0次
8 . 某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
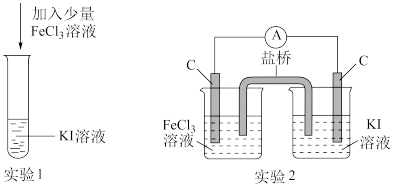

| A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2 |
| B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应 |
| C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应 |
| D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应 |
您最近一年使用:0次
名校
解题方法
9 . 某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
下列说法不正确的是( )
| 序号 | I | II | III |
| 实验步骤 | 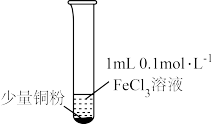 充分振荡,加2mL蒸馏水 |  充分振荡,加入2mL蒸馏水 | 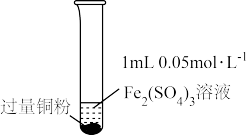 充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去, 变成蓝色,加入蒸馏水后无白色沉淀 |
| A.实验I、II、III中均发生了反应2Fe3++Cu=2Fe2++Cu2+ |
| B.对比实验I、II、III说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关 |
| C.实验I、III中加入蒸馏水后c(Cu2+)相同 |
| D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀 |
您最近一年使用:0次
2020-07-06更新
|
227次组卷
|
7卷引用:第7讲 铁及其化合物-2021年高考化学一轮复习名师精讲练
解题方法
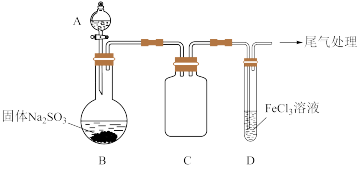
10 . 某校化学兴趣小组探究SO2与FeCl3溶液的反应,装置如下图所示。
已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。
步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和______ ,装置C的作用为:________________ 。
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:________
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:________________
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:__________ 。证明浅绿色溶液中含有Fe2+的实验操作为:_____________ 。
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
综合上述实验探究过程,得出的结论为:____________ 。
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是_________ 。

已知:
i.Fe(HSO3)2+离子为红棕色,它可以将Fe3+还原为Fe2+。
ii.生成Fe(HSO3)2+离子的反应为:Fe3+ +HSO
 ⇌Fe(HSO3)2+。
⇌Fe(HSO3)2+。步骤一:实验准备:
如上图连接装置,并配制100mL 1.0 mol·L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管D 中。
(1)配制100mL1.0 mol·L-1 FeCl3溶液用到的主要玻璃仪器为烧杯、玻璃棒、胶头滴管和
(2)用离子方程式解释1.0 mol·L-1 FeCl3溶液(未用盐酸酸化)pH=1的原因:
步骤二:预测实验
(3)该小组同学预测SO2与FeCl3溶液反应的现象为溶液由棕黄色变成浅绿色。
该小组同学预测的理论依据为:
步骤三:动手实验
(4)当SO2通入到FeCl3溶液至饱和时,同学们观察到的现象是溶液由棕黄色变成红棕色,将混合液放置12小时,溶液才变成浅绿色。
①SO2与FeCl3溶液反应生成了Fe(HSO3)2+离子的实验证据为:
②为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验。
| 实验I | 往5mL1mol·L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色。微热3 min,溶液颜色变为浅绿色。 |
| 实验II | 往5mL重新配制的1mol·L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色。几分钟后,发现溶液颜色变成浅绿色。 |
综合上述实验探究过程,得出的结论为:
步骤四:反思实验:
(5)在制备SO2的过程中,同学们发现,使用70%的硫酸比用98%的浓硫酸反应速率快,分析其中的原因是
您最近一年使用:0次



