1 . 已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+ 以及部分污泥,通过下列流程可从该废水中回收FeSO4·7H2O晶体及金属Cu。

(1)步骤1的主要操作是_________ ,需用到的玻璃仪器除烧杯外有______________ 。
(2)步骤2中发生反应的离子方程式为__________________________________ 。
(3)步骤3中发生反应的化学方程式为________________________________ 。
(4)步骤4中涉及的操作是:蒸发浓缩._____________ .过滤.洗涤.烘干。

(1)步骤1的主要操作是
(2)步骤2中发生反应的离子方程式为
(3)步骤3中发生反应的化学方程式为
(4)步骤4中涉及的操作是:蒸发浓缩.
您最近一年使用:0次
名校
解题方法
2 . 某工业废水中含有大量的FeSO4,较多的Cu2+和少量的Na+,工厂计划用下列方案从该废水中回收FeSO4·7H2O晶体和金属铜。

请问答下列问题:
(1)试剂D为___________ ;
(2)操作2为___________ 、冷却结晶,过滤;
(3)写出固体B与试剂D反应的离子方程式___________ ; 。
(4)某溶液中含有0.2 mol·L-1的 、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的
、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的 ,则
,则 的物质的量浓度为
的物质的量浓度为___________ 。

请问答下列问题:
(1)试剂D为
(2)操作2为
(3)写出固体B与试剂D反应的离子方程式
(4)某溶液中含有0.2 mol·L-1的
 、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的
、0.25 mol·L-1的Fe2+、0.4mol·L-1的Cl-及一定量的 ,则
,则 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
解题方法
3 . 现有中学化学常见四种金属单质A、B、C、I和三种常见气体甲、乙、丙及物质D、E、F、G、 H。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)

请根据以上信息回答下列问题:
(1)写出物质H的化学式:______________ ,物质E的名称: ______________ ;
(2)写出反应①的离子方程式__________ ;写出反应③的化学方程式______ ;写出反应⑦的离子方程式_________ ;

请根据以上信息回答下列问题:
(1)写出物质H的化学式:
(2)写出反应①的离子方程式
您最近一年使用:0次
名校
解题方法
4 . 三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
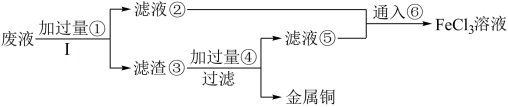
(1)写出下列物质的化学式①___ 、⑥___ 。
(2)步骤Ⅰ的操作名称:___ 。
(3)写出FeCl3溶液与铜发生反应的离子方程式:_______ 。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为__ 色沉淀,此过程所涉及反应的化学方程式为:______ 、___ 。
(5)通入⑥发生反应的离子方程式:________ 。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是___ (填字母代号)。
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无

(1)写出下列物质的化学式①
(2)步骤Ⅰ的操作名称:
(3)写出FeCl3溶液与铜发生反应的离子方程式:
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为
(5)通入⑥发生反应的离子方程式:
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A 有铜无铁 B 有铁无铜 C 铁、铜都有 D 铁、铜都无
您最近一年使用:0次
解题方法
5 . 我国古代许多著作在化学学科知识上都体现出了一定水平的认识。其中《管子•地数》中有记载:“上有丹沙者,下有黄金;上有慈石者,下有铜金。”
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是_____ ;(填化学式)“慈石者磁石也”,请写出磁石溶于盐酸的离子方程式:_____ ;
Ⅱ.“铜金者,斑岩铜矿也。”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要流程如图:
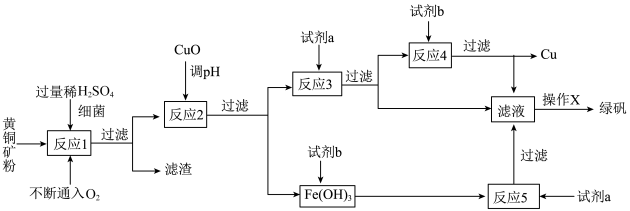
已知:①“反应1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
(1)“反应1”中,每生成1 mol CuSO4转移电子数为_____ NA;
(2)“试剂a”是_____ ,“试剂b”是_____ ;
(3)“反应2”中加CuO调pH为3.7~4.7的目的是_____ ;
(4)“操作X”应为_____ 、_____ 、过滤、洗涤;请简述上述“操作X”中如何对所得 FeSO4•7H2O晶体进行洗涤_____ ;
(5)简述如何判断“反应5”已进行完全:_____ 。
Ⅰ.“丹沙者丹砂也”,丹砂是古代炼丹的重要原料,也是实验室处理水银洒落后的产物。你认为丹砂主要成分是
Ⅱ.“铜金者,斑岩铜矿也。”
安徽宣城茶亭铜金矿床是长江中下游成矿带中新发现的一个大型斑岩型矿床。斑岩铜矿中Cu主要以铜﹣铁硫化物(主要为CuFeS2)的形式存在。以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要流程如图:

已知:①“反应1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表:
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)“试剂a”是
(3)“反应2”中加CuO调pH为3.7~4.7的目的是
(4)“操作X”应为
(5)简述如何判断“反应5”已进行完全:
您最近一年使用:0次
名校
解题方法
6 . 铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是__________________________ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:____________________ 。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是________ 。
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525 g白色沉淀,则溶液中c(Cl-)=________ mol·L-1。
③验证该溶液中含有Fe2+,正确的实验方法是______ 。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得21.525 g白色沉淀,则溶液中c(Cl-)=
③验证该溶液中含有Fe2+,正确的实验方法是
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液,滴入氯水,再滴入KSCN溶液,若显红色,证明原溶液中含有Fe2+
您最近一年使用:0次
名校
7 . 某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素。设计实验方案如图所示,回答下列问题。
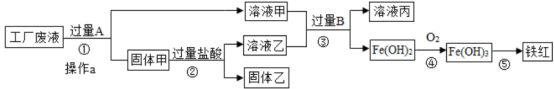
(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是______________________ 。
(2)工厂废液中加入过量A的目的是______________________________ 。
(3)溶液甲中的金属离子是_____________________ (写离子符号)。
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是________ (填序号)。
(5)步骤③中发生反应的化学方程式 是_____________________ 。

(1)加入过量A溶解后,在进行操作a时玻璃棒的作用是
(2)工厂废液中加入过量A的目的是
(3)溶液甲中的金属离子是
(4)步骤①②③中所发生的化学反应,其中属于置换反应的是
(5)步骤③中发生反应的化学方程式 是
您最近一年使用:0次
2017-09-21更新
|
367次组卷
|
3卷引用:安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(普通班)化学试题
安徽省滁州市定远县育才学校2019-2020学年高一上学期期末考试(普通班)化学试题山西省忻州市第一中学2017-2018学年高一上学期摸底考试化学试题(已下线)2019年1月4日 《每日一题》人教必修1-“铝三角”与“铁三角”



