名校
1 . 秦始皇兵马俑是世界文化遗产,兵马俑表面的彩绘体现了当时彩绘工艺和颜料制作工艺水平,具有极高的历史价值和艺术价值。下列对于兵马俑使用颜料的主要成分与其类别的对应关系正确的是

| 选项 | A | B | C | D |
| 颜色 | 绿色 | 棕红色 | 大红色 | 黑色 |
| 主要成分 | 石绿 | 赭石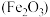 | 朱砂( ) ) | 炭黑(C) |
| 类别 | 碱 | 酸性氧化物 | 电解质 | 有机物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-16更新
|
396次组卷
|
4卷引用:江苏省无锡市第一中学2023-2024学年高一上学期期末考试化学试题
江苏省无锡市第一中学2023-2024学年高一上学期期末考试化学试题北京市中国人民大学附属中学2022-2023学年高一下学期期末考试化学试题(已下线)综合01 期末压轴80题之选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)河南省唐河县鸿唐高级中学2023-2024学年高三上学期8月月考化学试题
名校
2 . 回答下列问题:
(1) 可用作有机合成的催化剂。
可用作有机合成的催化剂。 是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
次磷酸 是一种强还原剂,将它加入
是一种强还原剂,将它加入 水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生
水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生 。写出生成CuH的化学方程式:
。写出生成CuH的化学方程式:___________ 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、 、
、 和
和 的百分组成。
的百分组成。 的盐酸溶液能吸收CO形成
的盐酸溶液能吸收CO形成 。
。
ii.保险粉 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。
请回答以下问题:
①G中测出的是___________ (填物质的化学式)的体积。
②F洗气瓶中宜盛放的试剂是___________ 。
(3)工业上可以在酸性介质中用 氧化浸出黄铜矿
氧化浸出黄铜矿 。
。
① 反应后转化为
反应后转化为 、
、 、
、 。将
。将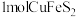 完全转化,理论上所需
完全转化,理论上所需 的物质的量为
的物质的量为___________ 。
②浸出过程中发现, 的反应实际用量远大于理论用量,原因是
的反应实际用量远大于理论用量,原因是___________ 。
③若浸出过程中,溶液中含有少量 ,则会析出黄钠铁矾
,则会析出黄钠铁矾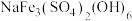 沉淀。写出
沉淀。写出 转化为黄钠铁矾沉淀的离子方程式:
转化为黄钠铁矾沉淀的离子方程式:___________ 。
(1)
 可用作有机合成的催化剂。
可用作有机合成的催化剂。 是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。
是一种难溶于水和乙醇的白色固体,露置于潮湿空气中易被氧化。次磷酸
 是一种强还原剂,将它加入
是一种强还原剂,将它加入 水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生
水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH,次磷酸转化为磷酸。待CuH生成后将HCl气体通入,可产生 。写出生成CuH的化学方程式:
。写出生成CuH的化学方程式:(2)某同学利用如下图所示装置,测定高炉煤气中CO、
 、
、 和
和 的百分组成。
的百分组成。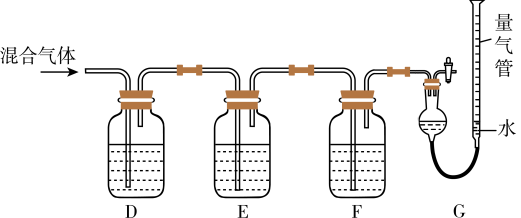
 的盐酸溶液能吸收CO形成
的盐酸溶液能吸收CO形成 。
。ii.保险粉
 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。请回答以下问题:
①G中测出的是
②F洗气瓶中宜盛放的试剂是
(3)工业上可以在酸性介质中用
 氧化浸出黄铜矿
氧化浸出黄铜矿 。
。①
 反应后转化为
反应后转化为 、
、 、
、 。将
。将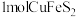 完全转化,理论上所需
完全转化,理论上所需 的物质的量为
的物质的量为②浸出过程中发现,
 的反应实际用量远大于理论用量,原因是
的反应实际用量远大于理论用量,原因是③若浸出过程中,溶液中含有少量
 ,则会析出黄钠铁矾
,则会析出黄钠铁矾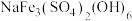 沉淀。写出
沉淀。写出 转化为黄钠铁矾沉淀的离子方程式:
转化为黄钠铁矾沉淀的离子方程式:
您最近一年使用:0次
解题方法
3 . 实验室可用反应 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作不能 达到实验目的的是
 来制备CuI(CuI受热易被氧化)。下列实验装置和操作
来制备CuI(CuI受热易被氧化)。下列实验装置和操作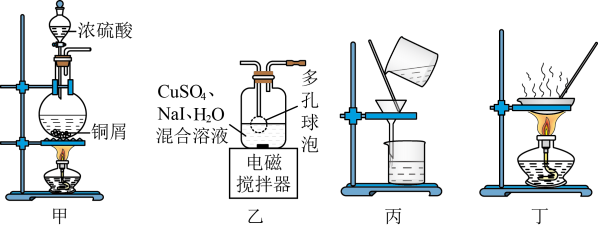
A.用甲装置制备 | B.用乙装置制备CuI |
| C.用丙装置分离出CuI | D.用丁装置干燥CuI固体 |
您最近一年使用:0次
名校
解题方法
4 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
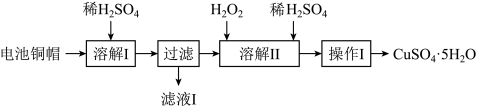
下列说法正确的是

下列说法正确的是
| A.滤液I中存在的主要阳离子有Zn2+、H+、Cu2+ |
| B.操作I为了尽可能多的得到CuSO4·5H2O晶体,应该将溶液蒸干 |
| C.溶解II过程发生反应的离子方程式为:Cu + H2O2 + 2H+ = Cu2+ + 2H2O |
| D.不可用操作I的方法从滤液I中提取ZnSO4·7H2O |
您最近一年使用:0次
5 . Ⅰ.印刷线路板废液(主要含有 、
、 、
、 、
、 、
、 等)可用来制备碱式碳酸铜,其化学式为
等)可用来制备碱式碳酸铜,其化学式为 ,过程可表示为
,过程可表示为
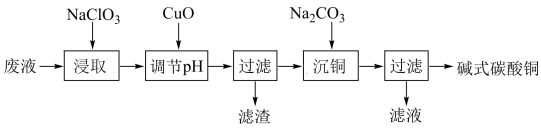
(1)已知滤渣的成分为氢氧化铁,“浸取”过程中发生了氧化还原反应,则“浸取”的离子方程式为:___________ 。
(2)下列物质中可以代替 “调节
“调节 ”且不影响滤液组成的是___。
”且不影响滤液组成的是___。
(3)“沉铜”需要一定温度的水浴加热,水浴加热所需的玻璃仪器有酒精灯、________ 、_________ 。
(4)铜在潮湿的空气中被腐蚀生成“铜绿”,其主要成分即为碱式碳酸铜。相应的化学方程式为:____ 。
Ⅱ.回收利用粉煤灰是解决工业废渣污染的重要途径。
粉煤灰(主要含 、
、 )可用于制备碱式硫酸铝
)可用于制备碱式硫酸铝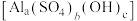 溶液。
溶液。
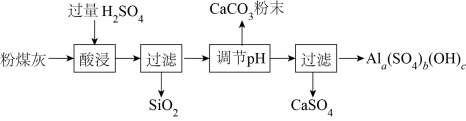
(5)加入 调节溶液
调节溶液 的目的有两个:①
的目的有两个:①_____________ 、②使硫酸铝转化为碱式硫酸铝。
(6)若 偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的
偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的 粉末使部分硫酸铝中的铝元素转化为:
粉末使部分硫酸铝中的铝元素转化为:_____________ (填化学式),同时产生 沉淀和无色无味的气体,其离子方程式为:
沉淀和无色无味的气体,其离子方程式为:________ 。
 、
、 、
、 、
、 、
、 等)可用来制备碱式碳酸铜,其化学式为
等)可用来制备碱式碳酸铜,其化学式为 ,过程可表示为
,过程可表示为
(1)已知滤渣的成分为氢氧化铁,“浸取”过程中发生了氧化还原反应,则“浸取”的离子方程式为:
(2)下列物质中可以代替
 “调节
“调节 ”且不影响滤液组成的是___。
”且不影响滤液组成的是___。A. | B.. | C.KOH | D. |
(4)铜在潮湿的空气中被腐蚀生成“铜绿”,其主要成分即为碱式碳酸铜。相应的化学方程式为:
Ⅱ.回收利用粉煤灰是解决工业废渣污染的重要途径。
粉煤灰(主要含
 、
、 )可用于制备碱式硫酸铝
)可用于制备碱式硫酸铝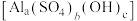 溶液。
溶液。
(5)加入
 调节溶液
调节溶液 的目的有两个:①
的目的有两个:①(6)若
 偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的
偏高,会导致溶液中的铝元素含量降低,其可能的原因是:加入的 粉末使部分硫酸铝中的铝元素转化为:
粉末使部分硫酸铝中的铝元素转化为: 沉淀和无色无味的气体,其离子方程式为:
沉淀和无色无味的气体,其离子方程式为:
您最近一年使用:0次
6 . 人类的生产和生活都离不开金属。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:
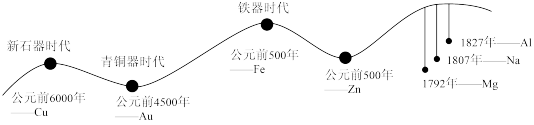
(1)由图可知人类最早使用的合金是___________ ;通过敲打可将金属材料打制成不同的形状,是利用了金属的___________ 性。
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是___________ (填序号)
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是________ (用化学方程式表示)
(二)实验室探究铜的冶炼
已知: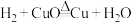 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
I、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。

(4)图1中制取氢气的化学反应方程式为____________________________________________ 。
(5)实验开始时,___________ (填序号)
A.先向长颈漏斗中加稀硫酸后点酒精灯 B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到___________ ,证明固体产物有Cu2O。
II、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。
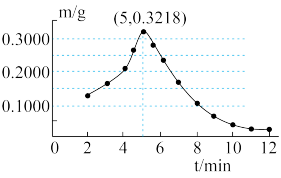
(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是____________ 。
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是___________ 。
III、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历 ,
, 两个反应,且在同一条件下两个反应同时进行。
两个反应,且在同一条件下两个反应同时进行。
假设2:依次经历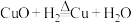 、
、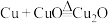 、
、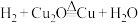 三个反应。
三个反应。
(9)结合探究II的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是___________________ 。(写出合理的推理过程)
(三)用废铜屑生产硫酸铜晶体(CuSO4∙5H2O)的流程如下:
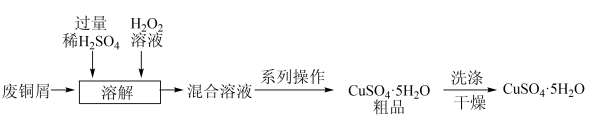
(10)“溶解”时发生的化学反应方程式为___________________ 。
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是_________ 。
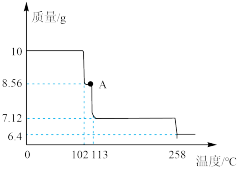
(12)取10g CuSO4∙5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4∙3H2O存在的最高温度约为___________ 。
(一)金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。历史上人类冶炼不同金属的大致年代如图所示:

(1)由图可知人类最早使用的合金是
(2)北宋沈插在《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾(硫酸铜晶体),熬胆矾铁釜,久之亦化为铜”。下列叙述正确的是
A.“苦泉”的溶质之一——CuSO4
B.“挹其水之”——蒸发溶剂
C.“熬胆矾铁釜,久之亦化为铜”——发生置换反应
(3)铝的利用距今100多年,现在铝的年产量得到大幅度的提高。铝虽然较活泼,但抗腐蚀性能好,原因是
(二)实验室探究铜的冶炼
已知:
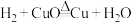 。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。
。有文献报道:在氢气还原氧化铜的一些实验中,得到的固体产物是铜和氧化亚铜(Cu2O)组成的混合物。氧化亚铜为红色固体,在空气中溶于氨水得到蓝色溶液,某兴趣小组对此开展如下探究。I、设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。

(4)图1中制取氢气的化学反应方程式为
(5)实验开始时,
A.先向长颈漏斗中加稀硫酸后点酒精灯 B.先点燃酒精灯加热后向长颈漏斗中加稀硫酸
(6)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到
II、探究反应生成Cu2O的变化情况。
称取若干份质量均为0.6000g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体中Cu2O的质量(m),结果如图2。

(7)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是
(8)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是
III、探究反应生成Cu2O的原因。
为解释实验结果,兴趣小组对氢气还原氧化铜的反应过程提出如下假设:
假设1:经历
 ,
, 两个反应,且在同一条件下两个反应同时进行。
两个反应,且在同一条件下两个反应同时进行。假设2:依次经历
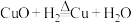 、
、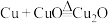 、
、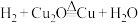 三个反应。
三个反应。(9)结合探究II的结果,通过计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是
(三)用废铜屑生产硫酸铜晶体(CuSO4∙5H2O)的流程如下:

(10)“溶解”时发生的化学反应方程式为
(11)“洗涤、干燥”过程中常用95%的酒精做洗涤剂,优点是
(12)取10g CuSO4∙5H2O,其受热脱水过程的热重曲线(剩余固体质量随温度变化的曲线)如图所示。则晶体CuSO4∙3H2O存在的最高温度约为

您最近一年使用:0次
7 . 铜、银位于周期表中第ⅠB族。铜、硫酸铜、硝酸银、银氨溶液是实验室常用的含铜或银的化学试剂。从废定影液[主要含有 、
、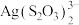 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关物质的性质与用途具有对应关系的是
,用苯萃取分液。下列有关物质的性质与用途具有对应关系的是
 、
、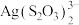 、
、 、
、 等微粒]中回收Ag和
等微粒]中回收Ag和 的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量
的主要步骤:向该废定影液中加入氢氧化钠调节pH在7.5~8.5之间,然后再加入稍过量 溶液沉银,过滤、洗涤及干燥,灼烧
溶液沉银,过滤、洗涤及干燥,灼烧 制Ag;滤液中通入
制Ag;滤液中通入 氧化
氧化 ,用苯萃取分液。下列有关物质的性质与用途具有对应关系的是
,用苯萃取分液。下列有关物质的性质与用途具有对应关系的是| A.铜具有良好导热性,可用作印刷电路板 | B.硫酸铜溶液显酸性,可用作泳池杀菌剂 |
| C.溴化银呈淡黄色,可用于制作相机胶片 | D.银氨溶液具有弱氧化性,可用于制作银镜 |
您最近一年使用:0次
2023-01-19更新
|
281次组卷
|
2卷引用:江苏省南通市海安市2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
8 . 下列有关物质性质与用途具有对应关系的是( )
| A.Na2S溶液具有碱性,可用于脱除废水中的Hg2+ |
| B.铝具有良好的导热性,可用铝槽车贮运浓硝酸 |
| C.NaHCO3能与碱反应,可用作食品疏松剂 |
| D.CuSO4能使蛋白质变性,可用于游泳池水的消毒 |
您最近一年使用:0次
名校
解题方法
9 . 现有 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到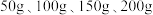 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表:
(1) 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为______ g。
(2)试求出混合溶液中 的溶质质量分数是
的溶质质量分数是______ ?(写出计算过程)
(3)混合溶液中 的溶质质量分数为
的溶质质量分数为______ 。
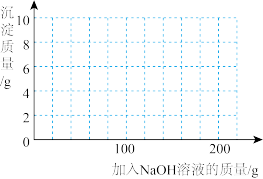
(4)若在 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图______ 。(在答题卡的坐标图中作图)
 与
与 的混合溶液,为了分析混合溶液中
的混合溶液,为了分析混合溶液中 与
与 的质量分数,设计如下实验方案:取四份混合溶液各
的质量分数,设计如下实验方案:取四份混合溶液各 ,分别缓慢加入到
,分别缓慢加入到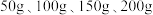 某
某 溶液中,测得四组实验数据如表:
溶液中,测得四组实验数据如表: | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | 第Ⅳ组 | |
 溶液的质量 溶液的质量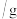 | 50 | 100 | 150 | 200 |
生成沉淀的质量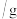 | 0 | 2.45 | 7.35 | 9.8 |
(1)
 混合溶液与
混合溶液与 溶液完全反应生成沉淀的质量为
溶液完全反应生成沉淀的质量为(2)试求出混合溶液中
 的溶质质量分数是
的溶质质量分数是(3)混合溶液中
 的溶质质量分数为
的溶质质量分数为(4)若在
 混合溶液中不断加入上述
混合溶液中不断加入上述 的溶液,请画出加入
的溶液,请画出加入 溶液的质量与所产生沉淀质量的关系图
溶液的质量与所产生沉淀质量的关系图
您最近一年使用:0次
10 . 工业上由含铜废料(含有Cu、CuS、CuSO4等)制备硝酸铜晶体的流程如图:
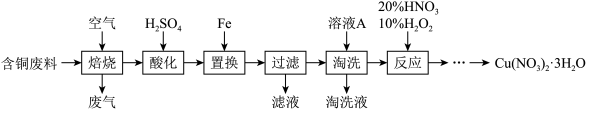
(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为___ 。
(2)“酸化”步骤反应的离子方程式为___ 。
(3)“过滤”所得滤液中溶质的主要成分为___ 。
(4)“淘洗”所用的溶液A应选用___ (填序号)。
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为___ 。
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式____ 。
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是___ 。(相关物质的溶解度曲线如图所示)
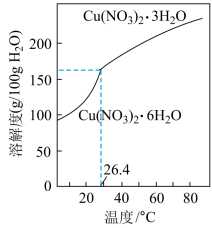

(1)“焙烧”时CuS转化为CuO和SO2,反应的化学方程式为
(2)“酸化”步骤反应的离子方程式为
(3)“过滤”所得滤液中溶质的主要成分为
(4)“淘洗”所用的溶液A应选用
a.稀硫酸 b.浓硫酸 c.稀硝酸 d.浓硝酸
(5)“反应”一步的过程中无红棕色气体生成。
①理论上消耗HNO3和H2O2的物质的量之比为
②若不加10% H2O2,只用浓HNO3,随着反应的进行,容器内持续出现大量红棕色气体,写出该反应的离子方程式
(6)由“反应”所得溶液中尽可能多地析出Cu(NO3)2·3H2O晶体的方法是

您最近一年使用:0次



