名校
解题方法
1 . 印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
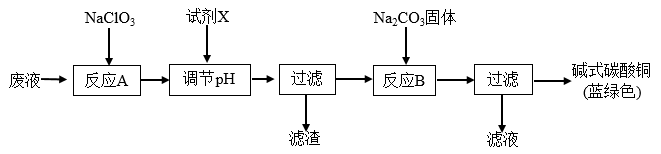
下列说法正确的是( )

下列说法正确的是( )
| A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O |
| B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜 |
| C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化 |
| D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去 |
您最近一年使用:0次
2020-05-13更新
|
302次组卷
|
4卷引用:江苏省扬州中学2021-2022学年高二下学期6月月考化学试题
江苏省扬州中学2021-2022学年高二下学期6月月考化学试题江苏省连云港市灌南二中、南师大灌云附中2022-2023学年高二下学期第二次阶段性检测化学试题山东省新高考质量测评联盟2020届高三5月联考化学试题(已下线)押广东卷化学第15题 离子方程式正误判断-备战2022年高考化学临考题号押题(广东卷)
名校
解题方法
2 . 某兴趣小组将过量Cu与FeCl3溶液充分反应,静置后取上层清液于试管中,将KSCN溶液滴加到清液中,观察到瞬间产生白色沉淀,局部出现红色;振荡试管,红色又迅速褪去。已知:
①CuCl2+Cu=2CuCl↓(白色)——该反应速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl——该反应速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是( )
①CuCl2+Cu=2CuCl↓(白色)——该反应速率很慢
②2CuCl2+4KSCN=2CuSCN↓(白色)+(SCN)2+4KCl——该反应速率很快
③(SCN)2是拟卤素,化学性质和氯气相似
下列说法正确的是( )
| A.用KSCN溶液检验Fe3+时,Cu2+的存在不会对检验产生干扰 |
| B.局部出现红色主要是因为溶液中的Fe2+被空气中的O2氧化成Fe3+,Fe3+与KSCN反应生成Fe(SCN)3 |
| C.白色沉淀是CuCl,是溶液中CuCl2与Cu反应生成的 |
| D.红色迅速褪去的原因是振荡试管时Cu2+与SCN-发生反应,从而使Fe3++3SCN-⇌Fe(SCN)3平衡逆移 |
您最近一年使用:0次
2020-05-10更新
|
939次组卷
|
16卷引用:江苏省扬州中学2021-2022学年高三上学期10月考化学试题
江苏省扬州中学2021-2022学年高三上学期10月考化学试题浙江省衢州、湖州、丽水三地市高三4月教学质量检测化学试题湖南省衡阳市第八中学2023-2024学年高三上学期10月月考化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)课时18 铜及其化合物 合金-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题03 铁 金属材料-2023年高考化学一轮复习小题多维练(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)湖南省湘西州吉首市2024届高三上学期第二届中小学生教师解题大赛化学试题陕西省渭南市2023-2024学年高三上学期教学质量检测化学试卷 陕西省渭南市2023-2024学年高三教学质量检测(Ⅰ)化学试题江西省宜春市丰城市第九中学日新班2023-2024学年高二上学期期末考试化学试题
名校
解题方法
3 . 以铜片(含少量杂质铁)为原料制取Cu(NO3)2溶液的实验流程如图:
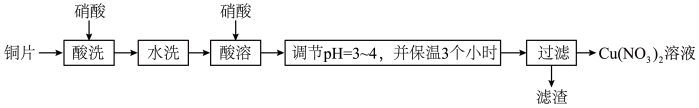
(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:___ 。
(2)“水洗”后检验铜片表面是否洗涤干净的方法是___ 。
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O
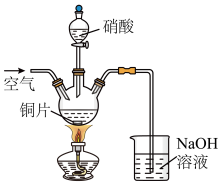
①“酸溶”时为防止反应过于剧烈,可以采取的方法有___ 和___ 。
②通入空气的作用是___ 、___ 。
(4)“调节pH=3~4,并保温3个小时”的目的是___ 。
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:___ 。
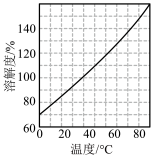
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

(1)“酸洗”的目的是除去铜片表面难溶的Cu2(OH)2SO4,写出“酸洗”时反应的离子方程式:
(2)“水洗”后检验铜片表面是否洗涤干净的方法是
(3)“酸溶”时的装置如图所示,烧杯内所发生的反应为:
NO+NO2+2OH-=2NO2-+H2O
2NO2+2OH-=NO2-+NO3-+H2O

①“酸溶”时为防止反应过于剧烈,可以采取的方法有
②通入空气的作用是
(4)“调节pH=3~4,并保温3个小时”的目的是
(5)烧杯中所得溶液经多步处理得到NaNO3固体。设计以烧杯中所得溶液为原料,制取NaNO3固体的实验方案:
[已知3NaNO2+2HNO3=3NaNO3+2NO↑+H2O;NaNO3的溶解度随温度变化如图所示。实验中必须使用的试剂:硝酸和NaOH溶液]。

您最近一年使用:0次
2020-05-09更新
|
139次组卷
|
2卷引用:江苏省如皋中学2020届高三阶段检测化学试题
4 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
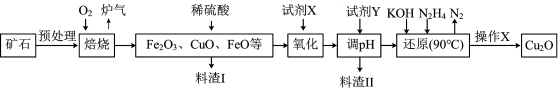
(1) “焙烧”时,提高反应速率的措施有____________ (写一条)。
(2)炉气中的有害气体成分是__________ 。
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:_________ 。

(1) “焙烧”时,提高反应速率的措施有
(2)炉气中的有害气体成分是
(3)若试剂X是H2O2溶液,写出相应反应的离子方程式:
您最近一年使用:0次
2019-12-25更新
|
116次组卷
|
2卷引用:江苏省太仓市明德高级中学2019-2020学年高二上学期合格性考试模拟化学试题
5 . 下列有关物质性质与用途具有对应关系的是
| A.次氯酸具有弱酸性,可用作有色物质的漂白剂 |
| B.硫酸铜溶液呈蓝色,可用作游泳池中水的消毒剂 |
| C.浓硫酸具有强氧化性,可用作酯化反应的催化剂 |
| D.铅具有还原性和导电性,可用作铅蓄电池的负极材料 |
您最近一年使用:0次
2019-05-17更新
|
103次组卷
|
4卷引用:江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题
江苏省徐州市王杰中学2021届高三12月份阶段性检测化学试题(已下线)江苏省七市(南通、泰州、扬州、徐州、淮安、宿迁、连云港)2019届高三第三次调研考试 化学试题江苏省常熟市王淦昌高级中学2022-2023学年高二上学期10月月考化学试卷吉林省长春市九台师范高中2020-2021学年高一下学期第二阶段考试化学试题
名校
6 . 下列俗名与物质相匹配的一组是( )
| A.水玻璃——Na2SO4 | B.小苏打——NaHCO3 | C.石膏——CaSiO3 | D.胆矾——FeSO4 |
您最近一年使用:0次
2019-03-09更新
|
329次组卷
|
8卷引用:江苏省江阴一中2018-2019学年高二上学期12月月考化学试题
江苏省江阴一中2018-2019学年高二上学期12月月考化学试题江苏省田家炳中学2018-2019学年高二第二学期学业水平测试第一次模拟考试化学试题广东省仲元中学2016-2017学年高二下学期期中考试(文)化学试题广东省韶关市新丰一中2016-2017学年高一下学期期末学业水平考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——硫及其化合物(强化练习)新疆维吾尔自治区喀什第六中学2022-2023学年高一上学期第一次月考化学试题广东实验中学2020-201学年高一下学期期中考试化学(合格考)试题广东省广州市广东实验中学2020-2021学年高一下学期期中考试(合格考)化学试题
名校
7 . 为探究某铜的硫化物组成,取一定量硫化物在氧气中充分灼烧,将生成的气体全部通入盛有足量的H2O2和BaCl2的混合液中,得到白色沉淀 4.66 g;将灼烧后的固体(仅含铜与氧2种元素)完全溶于100 mL 1 mol/LH2SO4中,过滤,得到0.64 g 红色固体,将滤液稀释至 200 mL,测得c(Cu2+)=0.1 mol/L。已知:Cu2O+ H2SO4 =CuSO4+Cu+H2O。
下列说法正确的是
下列说法正确的是
| A.得到白色沉淀亚硫酸钡 |
| B.原铜的硫化物中n(Cu)∶n(S)=2∶3 |
| C.最后所得的溶液最多可以溶解铁1.12 g |
| D.灼烧后的固体中n(Cu2O)∶n(CuO)=1∶1 |
您最近一年使用:0次
2019-03-06更新
|
876次组卷
|
7卷引用:江苏省扬州市2018-2019学年高二第二学期学业水平测试(必修)调研(二)化学试题
真题
名校
8 . 向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
| A.Cu与Cu2O的物质的量之比为2∶1 | B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L | D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
您最近一年使用:0次
2019-01-30更新
|
2788次组卷
|
33卷引用:安徽省肥东县高级中学2019届高三上学期12月调研化学试题
安徽省肥东县高级中学2019届高三上学期12月调研化学试题湖南省衡阳县第四中学2020届高三366班(实验班)8月月考化学试题宁夏青铜峡市高级中学2020届高三上学期第一次月考化学试题黑龙江省宾县一中2020届高三上学期第一次月考化学试题山西大学附中2020届高三上学期第二次模块诊断化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题天津市静海区第一中学2020届高三3月统练化学试题(已下线)【南昌新东方】2018-2019 莲塘一中 高三9月 013云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题江苏省南通市白蒲高级中学2019-2020学年高一下学期期末复习化学试题江苏省无锡市江阴市两校联考2023-2024学年高一下学期3月月考化学试题2012年普通高等学校招生全国统一考试理综化学部分(四川卷)(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷(已下线)2013届江西省赣州市十一县(市)高三上学期期中联考化学试卷2015-2016学年吉林省吉林一中高一下期末化学试卷江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年7月22日《每日一题》 2020届一轮复习 利用得失电子守恒巧解氧化还原反应计算题2020届高三化学总复习考点强化练习:物质及其变化2020届高三化学无机化学二轮专题复习——铜及其化合物专练【精编精炼】江西省景德镇一中2019-2020学年高一上学期期末考试(2班)化学试题(已下线)上海市奉贤区2014届高三1月调研(期末)测试化学试题(已下线)上海市奉贤区2013年高考二模化学试题(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测第29届(2015年)全国高中化学奥林匹克竞赛山东省预赛试题湖南省邵阳邵东市第一中学2022届高三上学期第二次月考化学试题河北深州市长江中学2021-2022学年高二上学期10月月考化学(文)试题云南省宁蒗县第一中学2021-2022学年高三下学期3月考试化学试题河南省洛阳市六校联考2022-2023学年高三上学期月考化学试题湖南省益阳市南县第一中学2023-2024学年高三上学期8月月考化学试题福建省福清第一中学2023-2024学年高三上学期10月月考化学试题四川省遂宁市射洪中学2020—2021学年高一下学期期中考试化学试题湖南省邵阳市第二中学2022-2023学年高一下学期期末考试化学试题上海市复兴高级中学2022-2023学年高二上学期期中考试化学(等级考)试题
2010·江苏泰州·一模
9 . 已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol∙L−1硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
您最近一年使用:0次
10 . 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________ 。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________ 。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______ 。(写出计算过程)
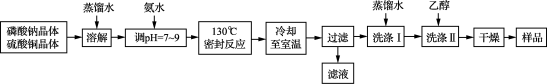
主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数
您最近一年使用:0次



