20-21高三下·浙江·阶段练习
解题方法
1 . 下列"类比“不合理的是
| A.H2O2热分解生成H2O和氧气,则FeS2热分解生成FeS和硫单质 |
| B.Ca(ClO)2溶液与CO2反应生成CaCO3和HClO,则NaClO溶液与CO2反应生成Na2CO3和HClO |
| C.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl |
| D.AgOH溶于氨水反应生成Ag(NH3)2OH,则Cu(OH)2溶于氨水生成Cu(NH3)4(OH)2 |
您最近一年使用:0次
20-21高一下·浙江绍兴·阶段练习
2 . 称取CuO和Fe2O3的固体混合物4.00 g,加入50.0 mL 2.00 mol/L的H2SO4充分反应,往所得溶液中加入5.60 g Fe粉,充分反应后,得到固体的质量为3.04 g。请计算:
(1)加入Fe粉充分反应后,溶液中溶质的物质的量_______ mol。
(2)固体混合物中CuO的质量分数_______ 。
(1)加入Fe粉充分反应后,溶液中溶质的物质的量
(2)固体混合物中CuO的质量分数
您最近一年使用:0次
解题方法
3 . 下列物质对于的名称错误的是
| A.Na2CO3-碳酸钠 | B.CuSO4-硫酸铜 | C.Na2SO3-硫酸钠 | D.FeCl2-氯化亚铁 |
您最近一年使用:0次
2021-03-19更新
|
205次组卷
|
3卷引用:浙江省嘉兴市八校联盟2021-2022学年高一上学期期中联考化学试题
名校
解题方法
4 . 氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属Cu和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解CuC12•2H2O制备CuCl,并进行相关探究。下列说法不正确的是
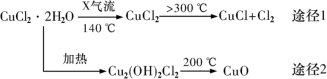
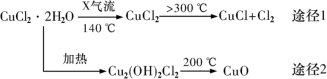
| A.途径1中产生的Cl2可以回收循环利用 |
B.途径2中200℃时反应的化学方程式为:Cu2(OH)2Cl2 2CuO+2HCl↑ 2CuO+2HCl↑ |
C.CuCl与稀硫酸反应的离子方程式为:2CuCl+4H++SO =2Cu2++2Cl-+SO2↑+2H2O =2Cu2++2Cl-+SO2↑+2H2O |
| D.X气体是HCl,目的是抑制CuCl2•2H2O加热过程可能的水解 |
您最近一年使用:0次
2021-03-17更新
|
484次组卷
|
14卷引用:浙江省宁波市慈溪市2021届高三适应性测试化学试题
浙江省宁波市慈溪市2021届高三适应性测试化学试题浙江省淳安县汾口中学2020-2021学年高二3月月考化学试题浙江省宁波市效实中学2020届高三上学期第一次模拟考试化学试题北京市昌平区新学道临川学校2021届高三上学期期末考试化学试题江西省宜春市丰城市第九中学2021-2022学年高三上学期第三次月考化学试题江西省南昌市第二中学2020届高三第四次月考化学试题江西省顶级名校2020届高三第四次联考化学试题江西省南昌市新建县第一中学2020届高三上学期第二次月考化学试题山西省晋中市平遥县和诚中学2020届高三上学期12月月考化学试题江西省南昌市进贤一中2019-2020学年高一上学期第二次月考化学试题2020届高三《新题速递·化学》12月第02期(考点01-06)黑龙江省哈尔滨师范大学附属中学2020-2021学年高三上学期开学考试化学试题江西省南昌市第二中学2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】2. 南昌二中 左佳鑫
5 . 甲酸铜[Cu(HCOO)2·4H2O]是一种重要的化工原料,可以用碱式碳酸铜与甲酸作用来制备。
实验步骤:
(Ⅰ)碱式碳酸铜的制备

(Ⅱ)甲酸铜的制备。碱式碳酸铜与甲酸反应制得蓝色四水甲酸铜:Cu(OH)2·CuCO3+4HCOOH+5H2O=2Cu(HCOO)2·4H2O+CO2↑。将产品碱式碳酸铜放入烧杯内,加入约20 mL 蒸馏水,加热搅拌至323 K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤。滤液在通风橱下蒸发至原体积的 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2·4H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2·4H2O产品,称量,计算产率。
回答下列问题:
(1)步骤(Ⅰ)将研磨后混合物注入热水后的现象是________________ 。
(2)步骤(Ⅰ)的后续“操作”有过滤、洗涤,其中检验沉淀已洗净的方法是__________________________________________________________________ 。
(3)本实验涉及三种固液分离的方法。
①倾析法使用到的仪器有___________________________________________ ;
②若采用减压过滤的装置对步骤(Ⅱ)中溶解后的溶液进行趁热过滤,操作的目的是____________________________________________________________________ 。
③步骤(Ⅱ)的实验中,需用到下列装置________ 。

④下列选项中,不能采用减压过滤的方法进行分离的是________ 。
A.Na2SiO3与盐酸混合所得的胶状沉淀
B.实验室用水杨酸和乙酸酐制得的阿司匹林
C.纳米级超细碳酸钙与水的混合液
D.苯酚与浓溴水混合后产生的沉淀
(4)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?__________________________________________________________________ 。
(5)用无水乙醇洗涤Cu(HCOO)2·4H2O晶体的目的是_____________________ 。
(6)最终称量所得的产品为7.91 g,则产率为________ 。
实验步骤:
(Ⅰ)碱式碳酸铜的制备

(Ⅱ)甲酸铜的制备。碱式碳酸铜与甲酸反应制得蓝色四水甲酸铜:Cu(OH)2·CuCO3+4HCOOH+5H2O=2Cu(HCOO)2·4H2O+CO2↑。将产品碱式碳酸铜放入烧杯内,加入约20 mL 蒸馏水,加热搅拌至323 K左右,逐滴加入适量甲酸至沉淀完全溶解,趁热过滤。滤液在通风橱下蒸发至原体积的
 左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2·4H2O产品,称量,计算产率。
左右,冷却至室温,减压过滤,洗涤,得Cu(HCOO)2·4H2O产品,称量,计算产率。回答下列问题:
(1)步骤(Ⅰ)将研磨后混合物注入热水后的现象是
(2)步骤(Ⅰ)的后续“操作”有过滤、洗涤,其中检验沉淀已洗净的方法是
(3)本实验涉及三种固液分离的方法。
①倾析法使用到的仪器有
②若采用减压过滤的装置对步骤(Ⅱ)中溶解后的溶液进行趁热过滤,操作的目的是
③步骤(Ⅱ)的实验中,需用到下列装置

④下列选项中,不能采用减压过滤的方法进行分离的是
A.Na2SiO3与盐酸混合所得的胶状沉淀
B.实验室用水杨酸和乙酸酐制得的阿司匹林
C.纳米级超细碳酸钙与水的混合液
D.苯酚与浓溴水混合后产生的沉淀
(4)在制备碱式碳酸铜的过程中,如果温度过高,对产物有何影响?
(5)用无水乙醇洗涤Cu(HCOO)2·4H2O晶体的目的是
(6)最终称量所得的产品为7.91 g,则产率为
您最近一年使用:0次
2021高三·浙江·专题练习
名校
6 . 为确定Fe2O3和Cu混合物的组成(假设混合均匀),某兴趣小组称取五份不同质量的样品,分别投入30.0 mL某浓度的稀硫酸中。充分反应后,每组样品剩余固体的质量与原样品质量的关系如图所示。下列说法不正确 的是
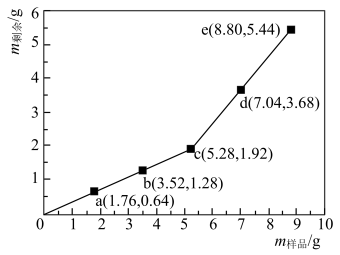

| A.各组样品均发生反应:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+ |
| B.1.76 g样品充分反应后,溶液中一定存在Fe2+和Cu2+,一定不存在Fe3+ |
| C.该混合物中n(Fe2O3)︰n(Cu)=1︰3 |
| D.稀硫酸的浓度为3.00 mol·L-1 |
您最近一年使用:0次
2021-03-13更新
|
780次组卷
|
5卷引用:解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练陕西省咸阳市实验中学2021-2022学年高一上学期第三次月考化学试题第三章 铁 金属材料(已下线)第3讲 铁盐及其亚铁盐
20-21高一·浙江·阶段练习
名校
解题方法
7 . 日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是
| A.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B.含亚铁离子的补血药丸采用糖衣包裹 |
| C.灶具大理石板被食醋腐蚀变得不光滑 |
| D.用煤气灶燃烧天然气为炒菜提供热量 |
您最近一年使用:0次
20-21高一·浙江·阶段练习
8 . 南北朝的陶弘景说:“鸡屎矾投苦酒(醋酸)中涂铁,皆作铜色,外虽铜色,内质不变”。鸡屎矾主要成分为碱式碳酸铜(Cu2(OH)2CO3)以及碱式硫酸铜(Cu2(OH)2SO4),可以用作外用消炎药。下列说法不正确的是
| A.以上信息可说明铁的金属活动性比铜的强 |
| B.等物质的量的碱式硫酸铜与碱式碳酸铜与醋酸反应,消耗醋酸量相同 |
| C.可以推测,鸡屎矾投入足量的苦酒中有气体产生 |
| D.可以推测,鸡屎矾能溶于盐酸 |
您最近一年使用:0次
9 . 称取8.00 g氧化铜和氧化铁固体混合物,加入100 mL2.00mol/L的硫酸充分溶解,往所得溶液中加11.2g铁粉,充分反应后,得固体的质量为6.08g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_______ 。
(2)固体混合物中氧化铜的质量_______ 。
(1)加入铁粉充分反应后,溶液中溶质的物质的量
(2)固体混合物中氧化铜的质量
您最近一年使用:0次
解题方法
10 . 某实验小组拟用碱性烂版液{主要成分为[Cu(NH3)4]Cl2和Cu(OH)2}为原料制取摩尔盐,并回收铜单质,设计流程如图:

已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式_______ 。
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是_______ 。
(3)关于该实验过程的下列说法中正确的是_______ 。

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:_______ 。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:_______ 。
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为_______ 。


已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是
(3)关于该实验过程的下列说法中正确的是

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为

您最近一年使用:0次



