解题方法
1 . 中华诗词中蕴含着许多化学知识。下列说法错误的是
| A.“铁孟汤雪早,石炭煮茶迟”中的“石炭”指的是煤 |
| B.“一般皎洁羞云母,四射光茫突水精”中“水精(精同晶)”的主要成分是二氧化硅 |
| C.“九秋风露越窑开,夺得千峰翠色来”中的“翠色”来自氧化亚铜 |
| D.“墨滴无声入水惊,如烟袅袅幻形生”中的“墨滴”具有胶体的性质 |
您最近一年使用:0次
解题方法
2 . 用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
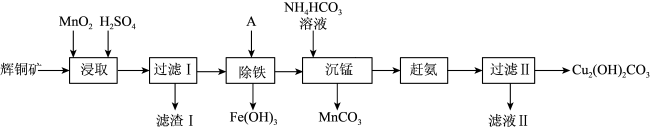
(1)下列措施能加快浸取速率的是___________ 。(填字母)
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:___________ 。
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(5)滤液Ⅱ所含溶质主要是___________ (填化学式)。

(1)下列措施能加快浸取速率的是
A.适当增大硫酸浓度 B.将辉铜矿粉碎 C.延长浸取时间
(2)滤渣I中的主要成分是MnO2、S、SiO2,写出“浸取”反应中生成S的离子方程式:
(3)“除铁”的方法是通过调节溶液pH,使Fe3+转化为Fe(OH)3,则加入的试剂A最好是___________。
| A.CO2 | B.CuO | C.氨水 | D.HCl |
(4)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(5)滤液Ⅱ所含溶质主要是
您最近一年使用:0次
3 . 下表中,对陈述I、II的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述II | 判断 |
| A | 碳酸钠溶液显碱性 | 碳酸钠可做胃酸中和剂 | I对,II对,无 |
| B | Fe2+可以与酸性 KMnO4 发生氧化还原反应,能使酸性高锰酸钾溶液褪色 | 用酸性 KMnO4 溶液检验 Fe2(SO4)3溶液中是否含有 FeSO4 | I对,II对,有 |
| C | 铝单质既能与盐酸反应放出氢气,又能与氢氧化钠溶液反应放出氢气 | 常温下铝制容器可以盛装浓硫酸 | I对,II对,有 |
| D | 铜绿的主要成分是碱式碳酸铜,碱式碳酸铜能溶于稀盐酸 | 可用盐酸除去铜器表面的铜绿 | I对,II错,无 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 硫酸铜晶体、硫酸四氨合铜晶体 均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
(1)兴趣小组用图所示装置进行硫酸铜的制备,二连球的作用是鼓入空气。CuCl是白色难溶于水的固体, 是墨绿色难溶于水的固体。
是墨绿色难溶于水的固体。
①三颈烧瓶中主要涉及三个反应,写出反应Ⅱ的化学方程式。
反应Ⅰ.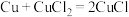
反应Ⅱ.___________
反应Ⅲ.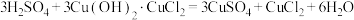
②按如图所示装置连接并加好试剂后,进行如下操作:
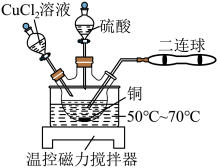
操作1:向三颈烧瓶中加入一定量的 溶液,充分搅拌至有大量白色固体生成;
溶液,充分搅拌至有大量白色固体生成;
操作2:鼓入空气,待有大量墨绿色固体生成后,滴加稀硫酸至墨绿色固体完全溶解;
重复操作2至铜完全溶解。
操作1中加入 溶液不能过多的原因是
溶液不能过多的原因是___________ ,也不能过少的原因是___________ 。
③Cu和浓硫酸直接反应也可制取硫酸铜,与上述实验方案相比,Cu和浓硫酸直接反应制取硫酸铜的缺点有___________ 和___________ 。
(2)黄铜矿(主要成分为 )可用于制取
)可用于制取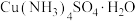 晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有
晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有 、
、 和
和 。设计由浸出液制取
。设计由浸出液制取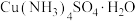 晶体的实验方案:
晶体的实验方案:___________ ,得到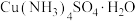 晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、
晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、 溶液、3%
溶液、3% 溶液、无水乙醇)
溶液、无水乙醇)
已知Ⅰ.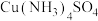 加热时易失去
加热时易失去
Ⅱ.实验中金属离子开始沉淀为氢氧化物及沉淀完全的pH如下表所示:
 均是常见的含铜化合物,可以由铜或含铜矿物制取得到。
均是常见的含铜化合物,可以由铜或含铜矿物制取得到。(1)兴趣小组用图所示装置进行硫酸铜的制备,二连球的作用是鼓入空气。CuCl是白色难溶于水的固体,
 是墨绿色难溶于水的固体。
是墨绿色难溶于水的固体。①三颈烧瓶中主要涉及三个反应,写出反应Ⅱ的化学方程式。
反应Ⅰ.
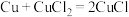
反应Ⅱ.
反应Ⅲ.
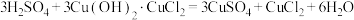
②按如图所示装置连接并加好试剂后,进行如下操作:

操作1:向三颈烧瓶中加入一定量的
 溶液,充分搅拌至有大量白色固体生成;
溶液,充分搅拌至有大量白色固体生成;操作2:鼓入空气,待有大量墨绿色固体生成后,滴加稀硫酸至墨绿色固体完全溶解;
重复操作2至铜完全溶解。
操作1中加入
 溶液不能过多的原因是
溶液不能过多的原因是③Cu和浓硫酸直接反应也可制取硫酸铜,与上述实验方案相比,Cu和浓硫酸直接反应制取硫酸铜的缺点有
(2)黄铜矿(主要成分为
 )可用于制取
)可用于制取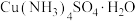 晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有
晶体。将黄铜矿在有氧条件下用硫酸浸出,所得浸出液中含有 、
、 和
和 。设计由浸出液制取
。设计由浸出液制取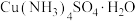 晶体的实验方案:
晶体的实验方案: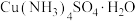 晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、
晶体。(实验中须使用的试剂有:1 mol⋅L-1氨水、 溶液、3%
溶液、3% 溶液、无水乙醇)
溶液、无水乙醇)已知Ⅰ.
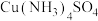 加热时易失去
加热时易失去
Ⅱ.实验中金属离子开始沉淀为氢氧化物及沉淀完全的pH如下表所示:
 |  |  | |
| 开始沉淀的pH | 1.9 | 4.7 | 5.8 |
| 沉淀完全的pH | 3.2 | 6.7 | 9.0 |
您最近一年使用:0次
2024-02-24更新
|
332次组卷
|
2卷引用:江苏省 徐州市第七中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
5 . 化学为生活创造美。下列说法正确的是
| A.用氢氟酸在玻璃上雕刻花纹,利用了氢氟酸的强酸性 |
| B.节日里的烟花表演利用了焰色试验,焰色试验属于化学变化 |
| C.游泳池里定期添加硫酸铜,主要目的是使池水更美丽梦幻 |
| D.发黑的银首饰置于盛有热食盐溶液的锡纸碗中,很快恢复光亮,利用了氧化还原反应 |
您最近一年使用:0次
2024-01-07更新
|
202次组卷
|
3卷引用:广东省部分学校2023-2024学年高三上学期11月统一调研考试化学试题
6 . 下列有关实验方案设计、现象和结论均正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 将滴有少量浓氨水的集气瓶倒扣在滴有少量浓硫酸的集气瓶上方 | 集气瓶内产生大量白烟 | 氨气和硫酸反应生成了硫酸铵 |
| B | 硫酸铜氨溶液中滴加少量硫酸 | 产生蓝色沉淀 | 硫酸根离子浓度增大,硫酸铜氨溶解度降低 |
| C | 将缠有锌条的铁钉置于装有少量食盐水的培养皿中,一段时间后,向铁钉附近滴加 溶液 溶液 | 未出现蓝色沉淀 | 锌条对铁钉起到保护作用 |
| D | 将5mL1-溴丁烷、15mL无水乙醇和2.0gNaOH混合,微热,并将产生气体通入 的 的 溶液 溶液 | 溴的四氯化碳溶液褪色 | 1-溴丁烷发生消去反应,生成1-丁烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
7 . 下列除杂方法正确的是
| 选项 | 物质(杂质) | 除杂方法 |
| A | 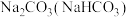 | 加热至恒重 |
| B |  | 加入足量稀盐酸,过滤 |
| C | 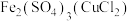 | 加入足量铁粉,过滤 |
| D | 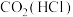 | 用饱和 溶液洗气 溶液洗气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-01更新
|
481次组卷
|
3卷引用:河北省邢台市质检联盟2023-2024学年高一上学期11月月考化学试题
名校
解题方法
8 . CuCl常用作催化剂、杀菌剂、媒染剂、脱色剂和冶金工业等。实验室用如下装置(夹持仪器略去)将二氧化硫通入新制 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
(1)仪器a的名称是_______ ,装置A中分液漏斗中盛装的试剂为_______ 。
(2)装置B的作用是_______ 。
(3)装置D的作用是_______ ,其中发生反应的离子方程式为_______ 。
(4) 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为_______ 。
(5)装置C中 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
①先用水洗再用乙醇洗涤的目的是_______ 。
②该实验所得CuCl的产率为_______ %。
 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。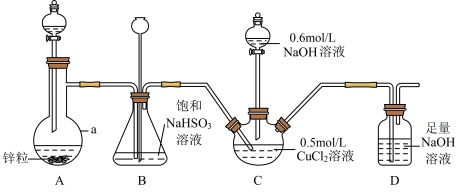
(1)仪器a的名称是
(2)装置B的作用是
(3)装置D的作用是
(4)
 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为(5)装置C中
 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。①先用水洗再用乙醇洗涤的目的是
②该实验所得CuCl的产率为
您最近一年使用:0次
2023-11-05更新
|
273次组卷
|
3卷引用:重庆市2023-2024学年高三上学期11月调研测试化学试题
9 . 现对一批已生锈的弹壳进行回收利用,主要流程如下:
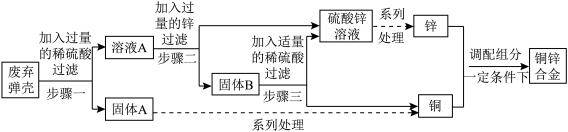
(资料)①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
(1)为加快步骤一的反应速率,可采用的方法是___________ (填一种即可);
(2)溶液A中的溶质是(写化学式)___________ ;固体B含有的物质为(写化学式)___________ ;
(3)步骤三中发生反应的化学方程式为___________ ;
(4)回收锌的质量___________ 废弃弹壳中锌元素的质量(选填“大于”、“小于”或“等于”);
(5)改变铜锌合金中锌的含量可以得到不同机械性能的黄铜。现欲制备120吨(t)含锌量小于35%的黄铜,该类黄铜具有良好的塑性,能承受冷热加工,但在200℃~700℃之间热加工时易断裂。下列符合原料配比及热加工条件的是___________ (填字母序号)。
a.锌44t 铜76t 750℃ b.锌38t 铜82t 500℃
c.锌55t 铜65t 190℃ d.锌25t 铜95t 750℃

(资料)①该弹壳由铜锌合金制成,其锈的主要成分是Cu2(OH)2CO3。
②Cu2(OH)2CO3能与稀硫酸反应生成硫酸铜,其他杂质不溶于水,也不参与反应。
(1)为加快步骤一的反应速率,可采用的方法是
(2)溶液A中的溶质是(写化学式)
(3)步骤三中发生反应的化学方程式为
(4)回收锌的质量
(5)改变铜锌合金中锌的含量可以得到不同机械性能的黄铜。现欲制备120吨(t)含锌量小于35%的黄铜,该类黄铜具有良好的塑性,能承受冷热加工,但在200℃~700℃之间热加工时易断裂。下列符合原料配比及热加工条件的是
a.锌44t 铜76t 750℃ b.锌38t 铜82t 500℃
c.锌55t 铜65t 190℃ d.锌25t 铜95t 750℃
您最近一年使用:0次
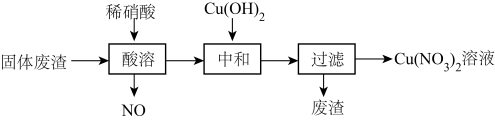
10 . 某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2。利用该固体废渣制取Cu(NO3)2溶液的工艺流程如图所示:
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为___________ ;
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___________ ;
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是___________ ;
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式___________ ;
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是___________ ;
(6)以某工业废水(主要含Cu2+、Na+、SO )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入___________ ,洗涤,干燥。(须使用的试剂有:蒸馏水、1mol/L NaOH溶液、1mol/LHNO3溶液;Cu(NO3)2的溶解度曲线如图所示。)
②SiO2是酸性氧化物,难于水和酸。
(1)写出Cu2O与稀硝酸反应的离子反应方程式为
(2)酸溶时,反应温度不宜超过70℃,其主要原因是
(3)将酸溶步骤排放的NO循环利用既环保又能提高产量,具体操作流程是
(4)酸溶试剂改用绿色氧化剂(10%H2O2和20%稀硝酸的混合液),基本无氮氧化物排放,写出废渣中Cu与绿色氧化剂反应的离子反应方程式
(5)中和试剂选择Cu(OH)2,若改为NaOH,缺点是
(6)以某工业废水(主要含Cu2+、Na+、SO
 )为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入
)为原料,设计制取Cu(NO3)2·3H2O晶体的实验方案:向工业废水中加入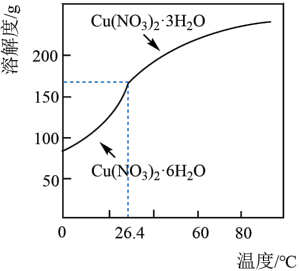
您最近一年使用:0次
2023-10-04更新
|
501次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高一下学期3月月考化学试题



