2020高二上·浙江·学业考试
名校
解题方法
1 . 煤的工业加工过程中,可利用CO和H2合成用途广泛的化工原料甲醇,能量变化如图所示。下列说法正确的是( )
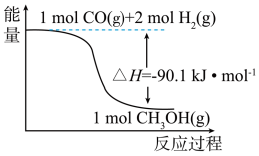

| A.该反应是吸热反应 |
| B.1molCH3OH所具有的能量为90.lkJ·mol-1 |
| C.1mol CO(g)和2mol H2(g)完全反应生成1mol CH3OH(l)时,放出90.1kJ热量 |
| D.1mol CO和2mol H2断键所需能量小于1mol CH3OH断键所需能量 |
您最近一年使用:0次
2020-11-20更新
|
123次组卷
|
3卷引用:福建省莆田第二十五中学2022-2023学年高一下学期期中考试化学试题
福建省莆田第二十五中学2022-2023学年高一下学期期中考试化学试题江苏省前黄高级中学 2020—2021学年高一下学期3月学情检测化学试题(已下线)2021年1月浙江省普通高中学业水平考试化学仿真模拟试卷01
单选题
|
适中(0.65)
|
名校
解题方法
2 . 已知化学反应A2(g)+B2(g)=2AB(g)的能量变化曲线如图所示,下列叙述正确的是( )
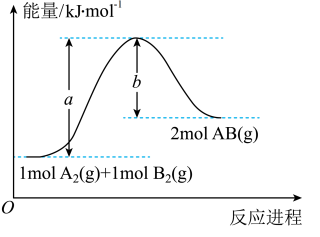

| A.该反应热ΔH=+(a-b)kJ·mol-1 |
| B.每生成2molAB(g)时吸收bkJ能量 |
| C.该反应中反应物的总能量高于生成物的总能量 |
| D.断裂1molA—A键和1molB—B键时放出akJ能量 |
您最近一年使用:0次
2020-11-09更新
|
616次组卷
|
24卷引用:福建省莆田第二十五中学2023-2024学年高一下学期第一次质量检测化学试题
福建省莆田第二十五中学2023-2024学年高一下学期第一次质量检测化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题湖南省邵阳市邵东县第一中学2018-2019学年高一下学期第三次月考化学试题山西省平遥中学2018-2019学年高一下学期期末考试化学试题江苏省淮安市高中校协作体2021-2022学年高一下学期期中考试化学试题广西河池市八校2021-2022学年高一下学期第二次联考化学试题江苏省宿迁市沭阳县潼阳中学2021-2022学年高一3月阶段测试化学试题福建省德化第一中学2022-2023学年高一下学期第一次月考化学试题云南省昭通市永善县明志高级中学2019—2020学年高二上学期期末考试化学试题湖北省黄石市2018-2019学年高二上学期期末质量监测考试化学试题安徽省涡阳县第一中学2019-2020学年高二3月月考化学试题北京市北京医学院附属中学2019-2020学年高二下学期期末考试化学试题河北省邢台市第二中学2020-2021学年高二上学期开学摸底考试化学试题福建省福州第三中学2019-2020学年高二上学期期末考试化学试题北京市丰台区 2020-2021 学年高三上学期期中考试化学试题天津市静海瀛海学校2020-2021学年高二上学期11月联考化学试题广东省中山市2020-2021学年高二上学期期末考试化学试题安徽省六安市舒城县舒州中学2020-2021学年高三12月月考化学试题山西省太原市山西英才学校2021-2022学年高二上学期月考化学试题天津市红桥区2021-2022学年高三上学期期中考试化学试题(已下线)第01练 反应热、热化学方程式-2022年【寒假分层作业】高二化学(人教版2019选择性必修1)云南省玉溪市民族中学2021-2022学年高二上学期期末考试化学试题云南省凤庆县第一中学2021-2022学年高二下学期3月份考试化学试题广东省揭阳市三所中学联考2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
3 . 反应2SO2(g)+O2(g) 2SO3(g)的能量变化如图所示,下列说法正确的是( )
2SO3(g)的能量变化如图所示,下列说法正确的是( )
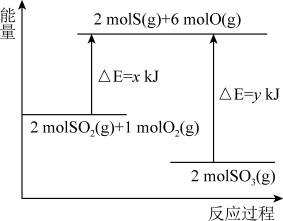
 2SO3(g)的能量变化如图所示,下列说法正确的是( )
2SO3(g)的能量变化如图所示,下列说法正确的是( ) 
| A.吸热反应一定要加热后才能发生 |
| B.该反应物总能量低于生成物总能量 |
C.2SO2(g)+O2(g) 2SO3(g)△H=(y-x)kJ/mol 2SO3(g)△H=(y-x)kJ/mol |
| D.2 mol S(g)、6 mol O(g)生成2 mol SO3(g),共放出y kJ能量 |
您最近一年使用:0次
名校
解题方法
4 . X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________ ;五种元素的原子半径从大到小的顺序是_________________ (用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B ,A的沸点比同主族其他气态氢化物___________ (填“高”或“低”),原因是________________________________ ,B中存在的化学键类型为____________ 。
A极性共价键 B非极性共价键 C 离子键
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为__________ ,其最高价氧化物对应的水化物化学式为__________ 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________ (填字母代号)。
a +99.7 kJ·mol-1 b +29.7 kJ·mol-1 c -20.6 kJ·mol-1 d -241.8 kJ·mol-1

(4)Y、硅与硫三种元素非金属性由强到弱的顺序为________________ (用元素符号表示)。某同学用如图所示装置验证Y、硅与硫三种元素非金属性强弱(夹持仪器已略去,气密性已检验)。Ⅰ、Ⅱ、Ⅲ所加入的试剂分别为:_________________________ (用化学式表示)。
(1)L的元素符号为
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B ,A的沸点比同主族其他气态氢化物
A极性共价键 B非极性共价键 C 离子键
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
a +99.7 kJ·mol-1 b +29.7 kJ·mol-1 c -20.6 kJ·mol-1 d -241.8 kJ·mol-1

(4)Y、硅与硫三种元素非金属性由强到弱的顺序为
您最近一年使用:0次
5 . (1)碳化铝,黄色晶体,熔点2200°C,熔融状态不导电,据此判断,碳化铝属于______ 晶体;水结冰后体积膨胀,与水分子间存在_________________ 有关。
(2)1 mol C在高温下与水蒸气反应,生成水煤气,吸收b kJ热量。写出反应的热化学方程式_____ 。
(3)今有如下三个热化学方程式:
H2(g)+1/2 O2(g)=H2O(g);ΔH=aKJ·mol-1
H2(g)+1/2 O2(g)=H2O(l);ΔH= bkJ·mol-1
2H2(g)+O2(g)=2H2O(l);ΔH=ckJ·mol-1
关于它们的下列表述正确的是________
A.a、b和c均为正值 B.a >b C.a <b D.2b = c
(4)现有两个反应:①NaOH + HCl = NaCl + H2O, ②Fe +H2SO4 = FeSO4 + H2 ↑。其中为放热反应的是_______ (填序号,下同)能设计成原电池的是______ ,若设计成原电池,则:(Fe:56)负极材料为_________ 、电极反应式为_____________ ;正极材料可以用_______ 、电极反应式为_____________________ 。如果反应中一个电极质量减少了2.8g,则放出的气体在标准状况下的体积为____________ L,转移的电子数目 为___________________ 。
(2)1 mol C在高温下与水蒸气反应,生成水煤气,吸收b kJ热量。写出反应的热化学方程式
(3)今有如下三个热化学方程式:
H2(g)+1/2 O2(g)=H2O(g);ΔH=aKJ·mol-1
H2(g)+1/2 O2(g)=H2O(l);ΔH= bkJ·mol-1
2H2(g)+O2(g)=2H2O(l);ΔH=ckJ·mol-1
关于它们的下列表述正确的是
A.a、b和c均为正值 B.a >b C.a <b D.2b = c
(4)现有两个反应:①NaOH + HCl = NaCl + H2O, ②Fe +H2SO4 = FeSO4 + H2 ↑。其中为放热反应的是
您最近一年使用:0次
6 . 氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) =2H2O(l) ΔH=-572kJ/mol
请回答下列问题:
(1)生成物能量总和____ (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量______ (填“>”、“<”或“=”)572 kJ。
请回答下列问题:
(1)生成物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量
您最近一年使用:0次



