1 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因_________ 。已知春季海水pH=8.1,预测夏季海水碱性将会_________ (填写“增强”或“减弱”),理由是________ (写出1条即可)
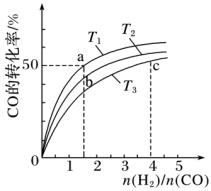
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g) CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是_________ (a、b点横坐标相同,a在曲线T1上,b在曲线T2上)
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:
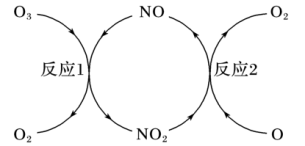
①NO的作用是__________________ 。
②已知:O3(g)+O(g)=2O2(g)△H =-143kJ·mol-1
反应1: O3(g)+NO(g) NO2(g)+O2(g)△H1=-200.2kJ·mol-1
NO2(g)+O2(g)△H1=-200.2kJ·mol-1
反应2:热化学方程式为______________________ 。
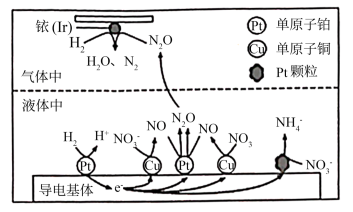
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为__________________________ 。
②若导电基体上的Pt颗粒增多,造成的后果是__________________________ 。
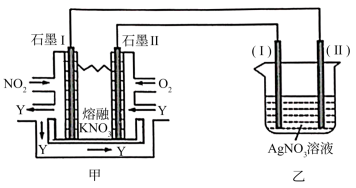
(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为__________________________ 。
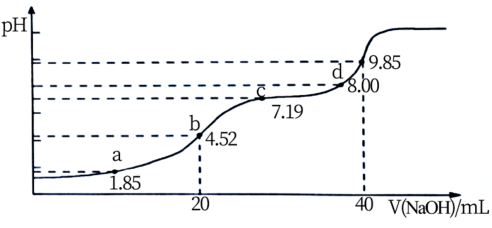
(6)大气污染物SO2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是__________________________ ;c点所得溶液中:c(Na+)__________ 3c(HSO3-)(填“>”、“<”或“=”)
(1)海水中无机碳的存在形式及分布如下图所示:用离子方程式表示海水呈弱碱性的原因
| 无机碳 | HCO3- | 90% |
| CO32- | 9% | |
| CO2 | 1% | |
| H2CO3 | ||
| 其中H2CO3仅为CO2的0.2% | ||

(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是
CH3OH(g)△H<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为lmol)与CO平衡转化率的关系。下列说法正确的是A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.a点(1.5,50)状态下再通入0.5 mol CO和0.5 mol CH3OH,平衡不移动
D.c点状态下再通入1 molCO和4molH2,新平衡中H2的体积分数增大
(3)NO加速臭氧层被破坏,其反应过程如图所示:

①NO的作用是
②已知:O3(g)+O(g)=2O2(g)△H =-143kJ·mol-1
反应1: O3(g)+NO(g)
 NO2(g)+O2(g)△H1=-200.2kJ·mol-1
NO2(g)+O2(g)△H1=-200.2kJ·mol-1反应2:热化学方程式为
(4)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-)从而降低水体中的氮含量,其工作原理如下图所示
①Ir表面发生反应的方程式为
②若导电基体上的Pt颗粒增多,造成的后果是


(5)利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示,甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II附近发生的电极反应式为
(6)大气污染物SO2可用NaOH吸收。已知pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。该温度下用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2SO3溶液的滴定曲线如下图所示。b点所得溶液中各离子浓度由大到小的顺序是

您最近一年使用:0次



