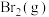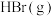1 . 由 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见图)中的重要反应之一
人工合成淀粉(节选途径见图)中的重要反应之一
反应②: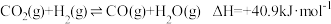
反应③: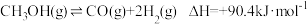
(1)反应①: 的
的
_______ 。
(2) 2的转化率与温度的关系如图所示。
2的转化率与温度的关系如图所示。_______ 逆反应速率(填“>或<或=”)。
②下列叙述能说明上述反应能达到化学平衡状态的是_______ 。(填字母)。
a.3v(CO2)=v(H2) b. 的体积分数不再改变
的体积分数不再改变
c.消耗1mol CO2的同时消耗3mol H2 d.混合气体的平均相对分子质量不再改变
③250℃后 2的平衡转化率降低的原因
2的平衡转化率降低的原因_______
(3)往一容积为 的密闭容器内,充入0.2mol CO2与
的密闭容器内,充入0.2mol CO2与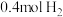 发生反应,反应达到c点时,从上图像可知在平衡时
发生反应,反应达到c点时,从上图像可知在平衡时 2的转化率是
2的转化率是_______ ,则c点时 的体积分数是
的体积分数是_______ ;平衡后再加入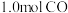 2后重新到达平衡,则H2的转化率
2后重新到达平衡,则H2的转化率_______ (填“增大”或“不变”或“减小”)。
 与
与 制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由
制备甲醇是当今研究的热点之一,也是我国科学家2021年发布的由 人工合成淀粉(节选途径见图)中的重要反应之一
人工合成淀粉(节选途径见图)中的重要反应之一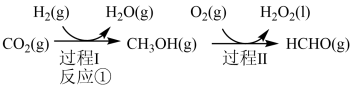
反应②:
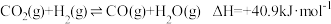
反应③:
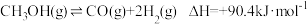
(1)反应①:
 的
的
(2)
 2的转化率与温度的关系如图所示。
2的转化率与温度的关系如图所示。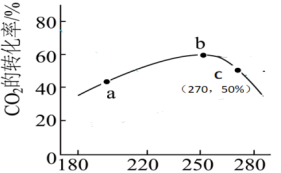
②下列叙述能说明上述反应能达到化学平衡状态的是
a.3v(CO2)=v(H2) b.
 的体积分数不再改变
的体积分数不再改变c.消耗1mol CO2的同时消耗3mol H2 d.混合气体的平均相对分子质量不再改变
③250℃后
 2的平衡转化率降低的原因
2的平衡转化率降低的原因(3)往一容积为
 的密闭容器内,充入0.2mol CO2与
的密闭容器内,充入0.2mol CO2与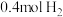 发生反应,反应达到c点时,从上图像可知在平衡时
发生反应,反应达到c点时,从上图像可知在平衡时 2的转化率是
2的转化率是 的体积分数是
的体积分数是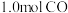 2后重新到达平衡,则H2的转化率
2后重新到达平衡,则H2的转化率
您最近一年使用:0次
2 . 反应①A+B→C ΔH1分两步进行:②A+B→X ΔH2,③X→C ΔH3.总反应过程中能量变化如图,下列说法正确的是
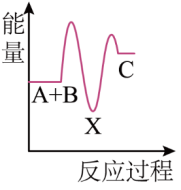
| A.总反应A+B→C ΔH1<0 |
| B.ΔH1=ΔH2 + ΔH3 |
| C.X的键能比C的键能小 |
| D.物质C比物质X稳定 |
您最近一年使用:0次
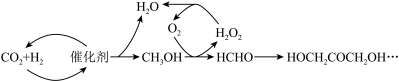
3 . 为尽快实现“碳达峰”“碳中和”,碳化学研究已成为当前科学研究的热点。由CO2合成淀粉的部分流程如图所示:
①
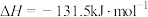
②
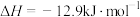
③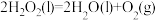
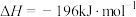
④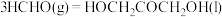
回答下列问题:
(1)反应①中,反应物的总能量_______ (填“大于”、“小于”或“等于”,下同)生成物的总能量,反应④中,反应物的总键能_______ 生成物的总键能。
(2)反应①中使用催化剂的作用有_______ (填标号);
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界_______ (填“吸收”或“放出”)的热量为______ kJ。(所有能量均充分利用,且不考㤐能量的损耗)
①

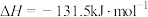
②

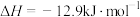
③
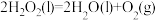
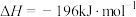
④
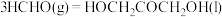
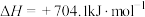
回答下列问题:
(1)反应①中,反应物的总能量
(2)反应①中使用催化剂的作用有
a.有效降低了反应活化能 b.提高了的平衡转化率 c.加快了反应①的反应速率
(3)CO2合成淀粉过程中,当有1kgCO2转化为HOCH2COCH2OH时,理论上反应体系共需向外界
您最近一年使用:0次
名校
4 . A、B、C是三种常见短周期元素的单质,常温下D为无色液体,E是一种常见的温室气体,F是化合物.其转化关系如图(反应条件和部分产物略去)。试回答:

(1)E的结构式是______ 。
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;______ ;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是______ 。
已知
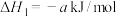
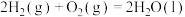
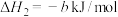
(4)已知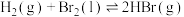
 ;蒸发1mol
;蒸发1mol 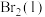 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为______ 。
(5)以NaCl等为原料制备 的过程如下:
的过程如下:
①在无隔膜、微酸性条件下电解,发生反应: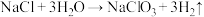 (未配平)。
(未配平)。
②在电解后溶液中加入KCl发生复分解反应,降温结晶,得
③一定条件下反应: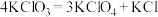 ,将产物分离得到
,将产物分离得到 。
。
该过程制得的 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: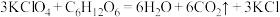 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度______ (用含c、V的代数式表示)。

(1)E的结构式是
(2)单质X和B或D均能反应生成黑色晶体Y,Y的化学式是;
(3)E的大量排放会引起很多环境问题.有科学家提出,用E和
 合成
合成 和
和 ,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是
,对E进行综合利用。25℃,101kPa时该反应的热化学方程式是已知

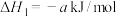
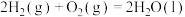
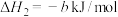
(4)已知
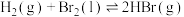
 ;蒸发1mol
;蒸发1mol 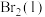 需要吸收的能量为30kJ,其它相关数据如下表。则表中a为
需要吸收的能量为30kJ,其它相关数据如下表。则表中a为物质 |
|
|
|
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | a | 369 |
(5)以NaCl等为原料制备
 的过程如下:
的过程如下:①在无隔膜、微酸性条件下电解,发生反应:
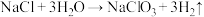 (未配平)。
(未配平)。②在电解后溶液中加入KCl发生复分解反应,降温结晶,得

③一定条件下反应:
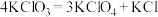 ,将产物分离得到
,将产物分离得到 。
。该过程制得的
 样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使
样品中含少量KCl杂质,为测定产品纯度进行如下实验:准确称取m g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使 全部转化为
全部转化为 ,反应为:
,反应为: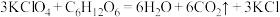 ,加入少量
,加入少量 溶液作指示剂,用
溶液作指示剂,用
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积V mL。滴定达到终点时,产生砖红色
溶液体积V mL。滴定达到终点时,产生砖红色 沉淀。计算
沉淀。计算 样品的纯度
样品的纯度
您最近一年使用:0次
2024-01-21更新
|
64次组卷
|
2卷引用:新疆乌鲁木齐市第九中学2023-2024学年高三上学期11月月考化学试题
名校
5 . 2008年9月我国“神七”发射升空,中国航天员实现首次太空行走。运载火箭的原料用肼( )作为发动机的燃料,
)作为发动机的燃料, 为氧化剂,反应生成氮气和水蒸气。已知:
为氧化剂,反应生成氮气和水蒸气。已知:
 kJ/mol,
kJ/mol,
 kJ/mol,下列判断正确的是
kJ/mol,下列判断正确的是
 )作为发动机的燃料,
)作为发动机的燃料, 为氧化剂,反应生成氮气和水蒸气。已知:
为氧化剂,反应生成氮气和水蒸气。已知:
 kJ/mol,
kJ/mol,
 kJ/mol,下列判断正确的是
kJ/mol,下列判断正确的是| A.所有物质与氧气发生的化学反应都是放热反应 |
B. 的燃烧热为534 kJ/mol 的燃烧热为534 kJ/mol |
C.肼与 反应的热化学方程 反应的热化学方程  kJ/mol kJ/mol |
| D.3.2 g肼完全反应转移的电子数为0.6 mol |
您最近一年使用:0次
名校
解题方法
6 . 在1200℃时,天然气脱硫工艺中会发生下列反应
①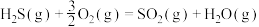
 ;
;
②
 ;
;
③
 ;
;

 ,则
,则 的正确表达式为
的正确表达式为
①
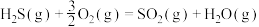
 ;
;②

 ;
;③

 ;
;
 ,则
,则 的正确表达式为
的正确表达式为A. | B.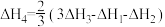 |
C. | D. |
您最近一年使用:0次
2023-12-23更新
|
162次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第一中学2022-2023学年高二上学期11月阶段性检测化学试题
7 . 25℃、101kPa下,①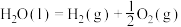
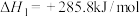
②
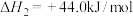
下列说法不正确 的是
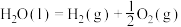
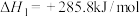
②

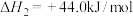
下列说法
| A.液态水变为水蒸气是物理变化 |
| B.水分解为氢气和氧气,断键吸收的总能量大于成键放出的总能量 |
C.标准状况下,22.4L水中含原子总数约为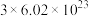 |
D.25℃、101kPa下, 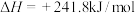 |
您最近一年使用:0次
2023-12-18更新
|
64次组卷
|
2卷引用:新疆乌鲁木齐市第六十八中学2023-2024学年高三下学期2月月考化学试题
名校
8 . 已知反应:
 kJ/mol可以有效转化汽车尾气。在密闭容器中充入2 mol CO和2 mol NO,平衡时NO的体积分数与温度、压强的关系如图所示;
kJ/mol可以有效转化汽车尾气。在密闭容器中充入2 mol CO和2 mol NO,平衡时NO的体积分数与温度、压强的关系如图所示;
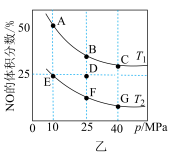
(1)充分反应达到平衡后,放出的热量Q___________ 746.5 kJ(选填“大于”、“小于”、“等于”)
(2)据图分析可知,
________  (选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________(填标号)
(选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________(填标号)
A.压缩容器体积 B.升高温度 C.恒压充入氦气 D.加入催化剂
(3)反应在D点达平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的___________ 点方向移动。
(4)工业上可用C与水蒸气在高温下制CO,反应原理为:
 。若向1 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
。若向1 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g  ,发生上述反应。达到平衡后,测得
,发生上述反应。达到平衡后,测得 的浓度为0.75 mol/L。若按如下配比改变起始加入量,则达到平衡后,
的浓度为0.75 mol/L。若按如下配比改变起始加入量,则达到平衡后, 的浓度仍为0.75 mol/L的是___________(填字母)。
的浓度仍为0.75 mol/L的是___________(填字母)。
(5)工业上可用CO制备甲醇( )。原理为:
)。原理为:
 。
。
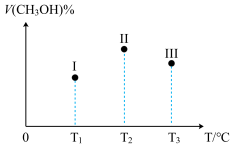
在Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中充入相同的CO和 ,三个容器的反应温度分别为
,三个容器的反应温度分别为 、
、 、
、 且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时
且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时 的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是
的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是___________ 。据此判断上述反应的
___________ (填“>”或“<”)0。
(6)CO可用于工业炼铁。原理为: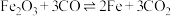 。在T℃、2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
。在T℃、2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
若甲容器中CO的平衡转化率为60%。则T℃时,乙容器中CO的平衡转化率为___________ 。

 kJ/mol可以有效转化汽车尾气。在密闭容器中充入2 mol CO和2 mol NO,平衡时NO的体积分数与温度、压强的关系如图所示;
kJ/mol可以有效转化汽车尾气。在密闭容器中充入2 mol CO和2 mol NO,平衡时NO的体积分数与温度、压强的关系如图所示;
(1)充分反应达到平衡后,放出的热量Q
(2)据图分析可知,

 (选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________(填标号)
(选填“大于”、“小于”、“等于”);反应平衡后,改变以下条件能使速率和两种污染气体转化率都增大的是___________(填标号)A.压缩容器体积 B.升高温度 C.恒压充入氦气 D.加入催化剂
(3)反应在D点达平衡后,若此时降低温度,同时压缩容器体积,在重新达到平衡过程中,D点会向A~G点中的
(4)工业上可用C与水蒸气在高温下制CO,反应原理为:

 。若向1 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g
。若向1 L容积不变的密闭容器中,加入24 g C,并使之均匀地平铺在容器底部,然后再加入18 g  ,发生上述反应。达到平衡后,测得
,发生上述反应。达到平衡后,测得 的浓度为0.75 mol/L。若按如下配比改变起始加入量,则达到平衡后,
的浓度为0.75 mol/L。若按如下配比改变起始加入量,则达到平衡后, 的浓度仍为0.75 mol/L的是___________(填字母)。
的浓度仍为0.75 mol/L的是___________(填字母)。A. | B.2 mol CO+2 mol  |
C.0.5 mol CO+0.5 mol  | D.27 g 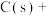 9 g 9 g  0.5 mol 0.5 mol 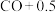 mol mol  |
(5)工业上可用CO制备甲醇(
 )。原理为:
)。原理为:
 。
。在Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中充入相同的CO和
 ,三个容器的反应温度分别为
,三个容器的反应温度分别为 、
、 、
、 且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时
且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时 的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是
的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是

(6)CO可用于工业炼铁。原理为:
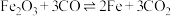 。在T℃、2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
。在T℃、2 L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。 | CO | Fe |  | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
您最近一年使用:0次
名校
解题方法
9 . 在298K、101kPa时,已知:



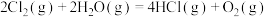

则 与
与 和
和 间的关系正确的是
间的关系正确的是




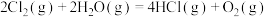

则
 与
与 和
和 间的关系正确的是
间的关系正确的是A.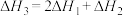 | B. |
C.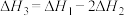 | D.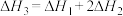 |
您最近一年使用:0次
2023-12-11更新
|
270次组卷
|
11卷引用:新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第二次月考化学试题
新疆兵团第三师图木舒克市鸿德实验学校2023-2024学年高二上学期第二次月考化学试题广东省江门市鹤山市第一中学2022-2023学年高二上学期第二阶段考试化学试题宁夏吴忠市盐池高级中学2019-2020学年高二上学期期末检测化学试题广东省普宁市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二上学期期中考试化学试题陕西省延安市富县高级中学2021-2022学年高一下学期期中考试化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题贵州省黔西南布依族苗族自治州2022-2023学年高二上学期期末考试化学试题北京市第五十中学2023-2024学年高二上学期期中考试化学试题广东省广州市第三中学、第四中学、培正中学2023-2024学年高二上学期期中考试化学试题福建省龙岩市永定区城关中学2023-2024学年高二上学期期中考试化学试题
名校
10 . 回答下列问题:
(1)现已知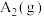 和
和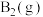 反应生成1 mol
反应生成1 mol 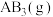 过程中能量变化示意如图。根据下列已知键能数据计算A-B键键能为
过程中能量变化示意如图。根据下列已知键能数据计算A-B键键能为________ kJ/mol。

(2)在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。

①从实验装置上看,图中缺少的一种玻璃仪器是________ 。烧杯间填满碎纸条的作用是________ 。若大烧杯上不盖硬纸板,求得的中和热△H________ (填“偏大”“偏小”或“无影响”)。
②甲同学用:50 mL 0.50 mol⋅L 盐酸与50 mL 0.55 mol⋅L
盐酸与50 mL 0.55 mol⋅L NaOH溶液进行中和反应,通过计算得到
NaOH溶液进行中和反应,通过计算得到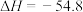 kJ/mol,该结果与
kJ/mol,该结果与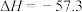 kJ⋅mol
kJ⋅mol 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是______ 。
A.用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用60 mL 0.50 mol⋅L 盐酸与60 mL 0.55 mol⋅L
盐酸与60 mL 0.55 mol⋅L NaOH溶液进行反应,与②中实验相比,所放出的热量
NaOH溶液进行反应,与②中实验相比,所放出的热量________ (填“相等”或“不相等”),若用50 mL 0.50 mol⋅L 醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会
醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会________ (填“偏大”、“偏小”或“不受影响”)。
(3) 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_______ (列式表示)。

(4)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
已知下列反应的热化学方程式:①

 kJ·mol
kJ·mol
②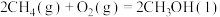

 kJ⋅mol
kJ⋅mol
反应③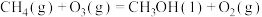 的
的
___________ kJ⋅mol ,平衡常数
,平衡常数
___________ (用 、
、 表示)
表示)
(1)现已知
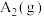 和
和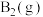 反应生成1 mol
反应生成1 mol 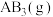 过程中能量变化示意如图。根据下列已知键能数据计算A-B键键能为
过程中能量变化示意如图。根据下列已知键能数据计算A-B键键能为
| 化学键 | A≡A | B-B |
| 键能(kJ/mol) | 946 | 436 |
(2)在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。

①从实验装置上看,图中缺少的一种玻璃仪器是
②甲同学用:50 mL 0.50 mol⋅L
 盐酸与50 mL 0.55 mol⋅L
盐酸与50 mL 0.55 mol⋅L NaOH溶液进行中和反应,通过计算得到
NaOH溶液进行中和反应,通过计算得到 kJ/mol,该结果与
kJ/mol,该结果与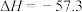 kJ⋅mol
kJ⋅mol 有偏差,产生此偏差的原因可能是
有偏差,产生此偏差的原因可能是A.用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用60 mL 0.50 mol⋅L
 盐酸与60 mL 0.55 mol⋅L
盐酸与60 mL 0.55 mol⋅L NaOH溶液进行反应,与②中实验相比,所放出的热量
NaOH溶液进行反应,与②中实验相比,所放出的热量 醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会
醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会(3)
 催化丙烷脱氢过程中,部分反应历程如图,
催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为
(4)甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
已知下列反应的热化学方程式:①


 kJ·mol
kJ·mol
②
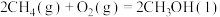

 kJ⋅mol
kJ⋅mol
反应③
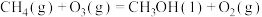 的
的
 ,平衡常数
,平衡常数
 、
、 表示)
表示)
您最近一年使用:0次