1 . 能源是人类可持续发展面临的重要问题,某科学家设计的UT-3热化学循环如下图所示:
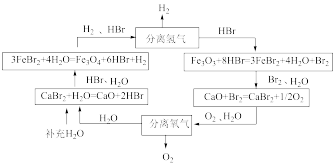
该过程最终制得的能源气体是

该过程最终制得的能源气体是
| A.H2 | B.O2 | C.HBr | D.Br2 |
您最近一年使用:0次
2020-06-23更新
|
78次组卷
|
2卷引用:河南省洛阳市2020-2021学年高一下学期期中考试化学试题
名校
解题方法
2 . 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。
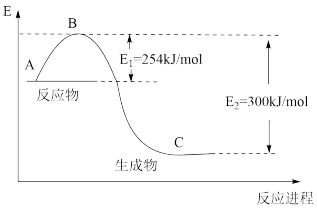
(2)若已知表中数据:
试根据表中及图中数据计算N-H的键能:_______ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:_______ 。
(4)N、H、O元素形成的离子化合物为_______ (填化学式)。
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
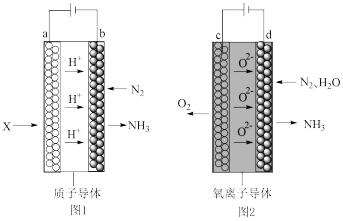
图1中,a 电极上通入的X 为_______ ;图 2 中,d 电极上的电极反应式为_______ 。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知表中数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能:
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:
(4)N、H、O元素形成的离子化合物为
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。

图1中,a 电极上通入的X 为
您最近一年使用:0次
名校
3 . 1 L 0.5 mol·L-1 H2SO4溶液与足量Ba(OH)2稀溶液反应放出a kJ热量;1 L 0.5 mol·L-1 HCl溶液与足量NaOH稀溶液充分反应放出b kJ热量;则500 mL 0.4 mol·L-1 BaCl2溶液与足量稀硫酸反应放出的热量为( )
| A.0.4(a+2b) kJ | B.0.4(a-2b) kJ |
| C.0.2(a-2b) kJ | D.0.2(a+2b) kJ |
您最近一年使用:0次
2017-06-24更新
|
196次组卷
|
5卷引用:黑龙江省哈尔滨市哈师大附中2020-2021学年高一下学期期中考试化学试题
名校
4 . 下列关于反应能量的说法正确的是
| A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH= -216 kJ·mol-1,则反应物的总能量大于生成物的总能量 |
| B.若一定条件下,A=B ΔH<0,说明A物质比B物质稳定 |
| C.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1,则H2的燃烧热为571.6 kJ·mol-1 |
| D.H+(aq)+OH-(aq)=H2O(l) ΔH= -57.3 kJ·mol-1,含1mol NaOH的溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
您最近一年使用:0次
2016-07-01更新
|
272次组卷
|
7卷引用:陕西省西安市高新一中2020-2021学年高一下学期5月月考化学试题
5 . 已知有如下热化学方程式
① 2C(s)+O2(g)=2CO(g) ΔH1
② 2H2(g)+O2(g)=2H2O(g) ΔH2
③ C(s)+ H2O(g)=CO(g) +H2(g) ΔH3
则下列关系正确的是:
① 2C(s)+O2(g)=2CO(g) ΔH1
② 2H2(g)+O2(g)=2H2O(g) ΔH2
③ C(s)+ H2O(g)=CO(g) +H2(g) ΔH3
则下列关系正确的是:
| A.ΔH3=(ΔH1+ΔH2)/2 | B.ΔH3= ΔH2-ΔH1 |
| C.ΔH3=(ΔH2-ΔH1)/2 | D.ΔH3= (ΔH1-ΔH2)/2 |
您最近一年使用:0次
2018-11-26更新
|
113次组卷
|
2卷引用:四川省珙县第一高级中学校2020-2021学年高一下学期第二次月考化学试题
6 . 研究表明:丰富的CO2可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g) CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
第二步:2CO(g)+4H2(g) C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
①CO2加氢合成乙烯的热化学方程式为___ 。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是___ (填字母)。
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
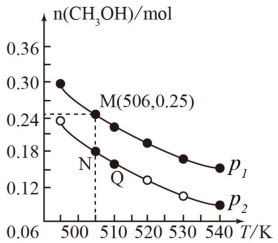
①上述反应的△H___ 0(填“>”或“<”),图中压强p1___ p2(填“>”或“<”)。
②经测定知Q点时容器的压强是反应前压强的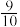 ,则Q点H2的转化率为
,则Q点H2的转化率为___ 。
③N点时,该反应的平衡常数K=___ (计算结果保留两位小数)。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)
 CO(g)+H2O(g) △H=+41.3kJ⋅mol-1
CO(g)+H2O(g) △H=+41.3kJ⋅mol-1第二步:2CO(g)+4H2(g)
 C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1
C2H4(g)+2H2O(g) △H=-210.5kJ⋅mol-1①CO2加氢合成乙烯的热化学方程式为
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是
A.减小压强 B.增大H2浓度 C.加入适当催化剂 D.分离出水蒸气
(2)另一种方法是将CO2和H2在催化剂条件下生成甲醇蒸气和水蒸气。现在10L恒容密闭容器中投入1molCO2和2.75molH2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
CH3OH(g)+H2O(g)。在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示:
①上述反应的△H
②经测定知Q点时容器的压强是反应前压强的
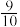 ,则Q点H2的转化率为
,则Q点H2的转化率为③N点时,该反应的平衡常数K=
您最近一年使用:0次
14-15高三上·浙江宁波·期末
7 . 2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:

①该反应的平衡常数表达式为_______ 。
②该反应的ΔH_______ 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线____ 。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g) ⇌ N2O4(g) =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式_______ 。
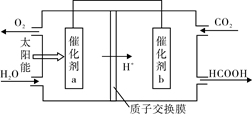
②将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。图为通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式_______ 。催化剂a、b之间连接导线上电子流动方向是_______ (填a→b或b→a) 。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)
 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
①该反应的平衡常数表达式为
②该反应的ΔH
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)
 =-867kJ·mol-1
=-867kJ·mol-12NO2(g) ⇌ N2O4(g)
 =-56.9kJ·mol-1
=-56.9kJ·mol-1写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式
②将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。图为通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式

您最近一年使用:0次
2019-01-30更新
|
1078次组卷
|
5卷引用:河南省商水县第二高中2020-2021学年高一下学期月考化学试题
解题方法
8 . Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
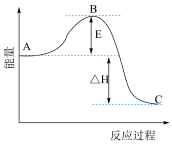
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次



