真题
名校
1 . 已知:2CO(g)+O2(g)=2CO2(g) ΔH=" --" 566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

Na2O2(s)+CO2(g)=Na2CO3(s)+ 1/2O2(g)ΔH=" --226" kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )

| A.CO的燃烧热为283 kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)ΔH< --452 kJ/mol |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
您最近一年使用:0次
2019-01-30更新
|
1537次组卷
|
18卷引用:2009年普通高等学校招生统一考试理综试题化学部分(天津卷)
2009年普通高等学校招生统一考试理综试题化学部分(天津卷)(已下线)2010年天津市天津一中高三第五次月考(理综)化学部分2009高考真题汇编-化学计算(已下线)北京市门头沟区2010年高三一模(理科综合)化学部分(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)09~10学年浙江舟山七校高二下学期期末考试化学试题(已下线)2010年黑龙江牡丹江一中高二上学期期中考试化学试卷(已下线)2010~2011学年辽宁省瓦房店市高级中学高一下学期期末考试(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2010-2011学年北京市密云二中高二下期3月份月考化学试卷(已下线)2012届浙江省东阳中学高三下学期阶段检测化学试卷(已下线)2011-2012学年安徽省安工大附中、红星中学高二3月联考化学试卷(已下线)2013届吉林省长春外国语学校高三第一次月考化学试卷(已下线)2012-2013学年黑龙江省鹤岗一中高一下学期期中考试化学试卷2015-2016学年江苏省启东中学高二上期中选修化学试卷2016届河南省顶级名校高三上学期期中测试化学试卷【全国百强校】辽宁省鞍山市第一中学2017-2018学年高一下学期期中考试化学试题湖南师大附属颐华学校2022-2023学年高二上学期入学考试化学试题
10-11高二下·云南昆明·期中
2 . 氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式分别为:
H2 (g) + O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /mol
CO(g) + O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /mol
C8H18 (l) +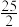 O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
CH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
H2 (g) +
 O2(g) = H2O (l) △H = -285.8 kJ /mol
O2(g) = H2O (l) △H = -285.8 kJ /molCO(g) +
 O2(g) = CO2(g) △H = -283 kJ /mol
O2(g) = CO2(g) △H = -283 kJ /molC8H18 (l) +
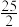 O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /mol
O2(g) = 8CO2(g) + 9H2O (l) △H = -5518 kJ /molCH4 (g) + 2O2(g) = CO2(g) + 2H2O (l) △H = -890.3 kJ /mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
| A.H2 (g) | B.CO(g) | C.C8H18 (l) | D.CH4 (g) |
您最近一年使用:0次
2020-09-30更新
|
539次组卷
|
31卷引用:2015-2016学年天津市和平区高二上学期期末考试化学试卷
2015-2016学年天津市和平区高二上学期期末考试化学试卷天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题(已下线)2010-2011学年云南省昆明一中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二上学期期中考试化学试卷(已下线)2011-2012学年福建省龙岩一中高二第一学段(模块)考试化学试卷(已下线)2011-2012学年河北省辛集三中高二化学选修四期中试卷(已下线)2012年人教版高中化学选修4 1.1化学反应与能量的变化练习卷(已下线)2012年苏教版高中化学选修4 1.1化学反应中的热效应(已下线)2015届安徽省望江中学同步课时练(人教选修4)1.2 燃烧热能源试卷2016-2017学年宁夏育才中学高二上第一次月考化学卷河北省邢台第三中学2017-2018学年高二9月月考化学试题四川省成都市七中实验学校2017-2018学年高二10月月考化学试题河北省安平中学2017-2018学年高一下学期期末考试化学试题22018-2019学年人教版高二化学选修四章:化学反应与能量末测试题(已下线)《2018-2019学年同步单元双基双测AB卷》第一单元 化学反应与能量单元测试(A卷)高二人教版选修4 第一章 第三节 化学反应热的计算【校级联考】河北省鸡泽县第一中学2018-2019学年高一下学期3月月考化学试题陕西省吴起高级中学2018-2019学年高一下学期第二次月考基础卷化学试题(已下线)2019年8月29日《每日一题》人教选修4—— 燃烧热的计算山东省德州市夏津县双语中学2019-2020学年高二上学期第二次月考化学试题湖南省常德市石门县第二中学2019-2020学年高二上学期第二次月考化学试题云南省勐海县第三中学2019-2020学年高二上学期期末考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1(已下线)1.3.2+反应热的计算-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)宁夏石嘴山市第三中学2020-2021学年高二上学期第一次月考化学试题湖南省娄底市第一中学2020-2021学年高二上学期9月月考化学试题河南省安阳县第三高级中学2020-2021学年高二上学期第一次阶段考试化学试题甘肃省玉门市2021-2022学年高二上学期 “研课标读教材”期中学业质量监测化学试题甘肃省玉门市2021-2022学年高二下学期 “研课标读教材”期中学业质量监测试化学试题(一)(已下线)1.1.2 反应热(二)-同步学习必备知识
3 . 下列叙述正确的是
| A.甲烷的燃烧热为ΔH=-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ·mol-1 |
| B.已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热ΔH=2×(-57.3)kJ·mol-1 |
| C.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0)kJ/mol |
D.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.3kJ·mol-1,则1mol SO2、0.5mol O2充分反应后,放出热量98.3kJ 2SO3(g) ΔH=-196.3kJ·mol-1,则1mol SO2、0.5mol O2充分反应后,放出热量98.3kJ |
您最近一年使用:0次
2021-10-07更新
|
396次组卷
|
5卷引用:天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题
天津市静海区四校2021-2022学年高二上学期11月阶段性检测化学试题福建省武平县第一中学2021-2022学年高二上学期第一次月考化学试题(已下线)必考点03 化学平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版2019选择性必修1)黑龙江省哈尔滨市松北区第九中学校2022-2023学年高二上学期12月期中考试化学试题黑龙江省哈尔滨市第九中学校2023-2024学年高二上学期12月考试化学试卷
9-10高二下·安徽·期中
名校
解题方法
4 . 已知热化学方程式:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
 O2(g)
O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为
SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为| A.196.64kJ | B.196.64kJ/mol | C.<196.64kJ | D.>196.64kJ |
您最近一年使用:0次
2021-02-23更新
|
380次组卷
|
58卷引用:2012-2013学年天津市天津一中高二上学期期中考试化学试卷
(已下线)2012-2013学年天津市天津一中高二上学期期中考试化学试卷天津市杨柳青一中2017-2018第一学期高二第一次化学月考天津市蓟州中学2022-2023学年高二上学期第一次月考化学试题(已下线)2010年安徽师大附中高二第二学期期中考查(已下线)2010年山西省山西大学附中高二上学期10月考化学(已下线)2010-2011学年广东省中山市桂山中学高二下期中考试化学试卷(已下线)2010—2011学年浙江省杭州外国语学校高二年级下学期期中考试化学试卷(已下线)2011-2012学年江西省会昌中学高二第二次月考化学试卷(已下线)2011-2012学年河南省濮阳市高二上学期期末考试化学试卷(已下线)2011-2012学年安徽省六安市徐集中学高二上学期期末考试化学试卷(已下线)2011-2012学年浙江省开化县华埠中学高二下学期3月月考试卷(已下线)2011-2012学年浙江省余姚中学高一下学期期中考试理科化学试卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高二9月月考化学试卷(已下线)2012-2013学年河南省郑州四中高二第一次月考化学试卷(已下线)2012-2013学年吉林省扶余一中高二上学期期末考试化学试卷(已下线)2013-2014学年内蒙古赤峰市元宝山区高二上学期期末化学试卷(已下线)2014秋河北省唐山一中高二上学期期中化学试卷2014-2015学年内蒙古巴市一中高二10月月考化学试卷2014-2015内蒙古赤峰市宁城县高二上学期期末考试化学试卷2015-2016学年内蒙古巴彦淖尔高二上10月月考化学试卷2015-2016学年海南省嘉积中学高二上12月段考化学试卷2017届山东省枣庄三中高三上学期9月质检化学试卷2016-2017学年贵州省贵阳六中高二上10月月考化学卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷河北省保定市2016-2017学年高一下学期期中考试化学试题陕西省西安市电子科技中学2017-2018学年高二上学期第一次月考化学试题福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题河北省邢台第三中学2017-2018学年高二9月月考化学试题甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题内蒙古翁牛特旗乌丹第二中学2017-2018学年高二上学期期中考试化学试题福建省三明市三地三校2017-2018学年高二上学期期中联考化学试题湖南辰溪博雅实验学校2018-2019学年高二8月月考化学试题甘肃省岷县第二中学2018-2019学年高二上学期期中考试化学试题甘肃省白银市靖远县第四中学2018-2019学年高二上学期期中考试化学试题高二人教版选修4 第二章 第三节 化学平衡【校级联考】吉林省辽源市田家炳高级中学(第六十六届友好学校)2018-2019学年高二上学期期末联考化学试题江苏省沭阳县2018-2019学年高二下学期期中调研测试化学试题内蒙古呼和浩特开来中学2019-2020学年高二上学期期中考试化学试题河北省张家口市宣化一中、张北一中2019-2020学年高二上学期期中联考化学试题河南省鹤壁市高级中学2018-2019学年高一下学期第一次段考化学试题河北省张家口市怀来县新保安第二中学2019-2020学年高二上学期11月月考化学试题2020年春季人教版高中化学选修4第一章《化学反应与能量》测试卷云南省普洱市景东彝族自治县第一中学2019-2020学年高一下学期期中考试化学试题黑龙江省哈尔滨师范大学青冈实验中学校2018-2019学年高二上学期开学考试化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题江西省赣州市南康中学2020-2021学年高二上学期第一次月考化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题吉林省榆树市第一高级中学2020-2021学年高二上学期期中考试化学试题云南省保山第九中学2019-2020学年高二下学期期末考试化学试题陕西省西安市庆华中学2020-2021学年高二上学期第一次月考化学试题湖南省郴州市湘南中学2019-2020学年高二上学期期中考试化学试题(高考班)黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题吉林省吉林市永吉县第四中学2021-2022学年高二上学期期中考试化学试题黑龙江省大兴安岭实验中学(西校区)2021-2022学年高二上学期期中考试化学试题陕西省西安市鄠邑区第二中学2022-2023学年高二上学期第一次月考化学试题 河南省兰考县第二高级中学2021-2022学年高二上学期期中考试化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题
5 . 以下反应均可制取O2。下列有关说法正确的是
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
反应①:2H2O(l)=2H2(g)+O2(g) △H1=+571.6 kJ·mol-1
反应②:2H2O2(l)=2H2O(1)+O2(g) △H2=-196.4 kJ·mol-1
| A.制取O2的反应一定是吸热反应 |
| B.H2的燃烧热为-571.6 kJ·mol-1 |
| C.若使用催化剂,反应②的△H将减小 |
| D.反应2H2O2(l)=2H2O(g)+O2(g)的△H>-196.4 kJ·mol-1 |
您最近一年使用:0次
2020-08-04更新
|
418次组卷
|
9卷引用:天津市崇化中学2022-2023学年高三上学期期末检测化学试题
天津市崇化中学2022-2023学年高三上学期期末检测化学试题江苏省南通中学2018-2019学年高二上学期期末教学质量调研化学(选修)试题江苏省徐州市2019-2020学年高二下学期期中抽测化学试题(已下线)第01章 化学反应与能量(A卷基础篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)新疆吾尔自治区石河子第二中学2020-2021学年高二上学期第一次月考化学试题辽宁省大连市普兰店第三十八中学2020-2021学年高二上学期第二次考试化学试题(已下线)第9单元 化学反应中的能量变化(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷湖南省郴州市2021-2022学年高二下学期期末考试化学试题黑龙江省大庆市大庆中学2023-2024学年高二下学期开学化学试题
名校
解题方法
6 . 根据热化学方程式S(s)+O2(g)==SO2(g)ΔH=—297.2kJ/mol分析,下列说法中不正确的是
| A.S(s)在O2(g)中燃烧是放热反应 |
| B.16g固体硫在空气中充分燃烧,可放出148.6kJ的热量 |
| C.反应S(g)+O2(g)==SO2(g)的ΔH大于—297.2kJ/mol |
| D.1molSO2(g)所具有的能量小于1molS(s)与1molO2(g)所具有的能量之和 |
您最近一年使用:0次
2020-04-29更新
|
258次组卷
|
5卷引用:天津市河北区2021-2022学年高二上学期期末质量检测化学试题
7 . 已知2A2(g)+B2(g) 2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
(1)比较a___________ b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应A的转化率将___________ (填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是___________
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是___________
 2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。(1)比较a
(2)若将反应温度升高到700 ℃,该反应A的转化率将
(3)能说明该反应已经达到平衡状态的是___________
| A.v(C3)=2v(B2) | B.容器内压强保持不变 |
| C.v逆(A2)=2v正(B2) | D.容器内的密度保持不变 |
| A.及时分离出C3气体 | B.适当升高温度 |
| C.增大B2的浓度 | D.选择高效的催化剂 |
您最近一年使用:0次
解题方法
8 . 反应N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol表示的意义为
2NH3(g) △H=-92.4kJ/mol表示的意义为
 2NH3(g) △H=-92.4kJ/mol表示的意义为
2NH3(g) △H=-92.4kJ/mol表示的意义为| A.1 mol N2 和3 mol H2 充入密闭容器中反应放出92.4kJ热量 |
| B.1 mol N2 和3 mol H2 充入密闭容器中反应吸收92.4kJ热量 |
| C.每生成2 mol NH3 放出92.4 kJ热量 |
| D.每生成2 mol NH3 吸收92.4 kJ热量 |
您最近一年使用:0次
10-11高二上·山西吕梁·阶段练习
名校
解题方法
9 . 已知H2(g)+Cl2(g)=2HCl(g) △H= ―184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为
| A.+184.6kJ·mol-1 | B.-92.3 kJ·mol-1 |
| C.-184.6 kJ·mol-1 | D.+92.3 kJ·mol-1 |
您最近一年使用:0次
2018-11-13更新
|
125次组卷
|
23卷引用:2016-2017学年天津市河东区高二上学期期中质检化学试卷
2016-2017学年天津市河东区高二上学期期中质检化学试卷(已下线)2010年山西省汾阳中学高二上学期第二次月考(化学)(已下线)2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一下学期期初考试化学试卷(已下线)2012-2013学年湖北省监利县柘木中学高二第一次月考化学试卷(已下线)2012-2013学年北京市房山区房山中学高二下学期期中考试化学试卷(已下线)2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)2015-2016学年青海省西宁四中高二上学期期末化学试卷四川省邻水实验学校2017-2018学年高二上学期第三次月考化学试题山西省汾阳市第二高级中学2018-2019学年高二上学期第二次半月考化学试题河北省邢台市第八中学2018-2019学年高二上学期期中考试化学试题陕西省黄陵中学高新部2018-2019学年高一第二学期期中考试化学试题陕西省黄陵县中学2018-2019学年高一(重点班)下学期期中考试化学试题广西壮族自治区贺州市桂梧高中2019-2020学年高二上学期第一次月考化学试题陕西省咸阳百灵中学2020-2021学年高二上学期第一次月考化学试题河南省周口市中英文学校2020-2021学年高二上学期第一次月考化学试题广西壮族自治区贺州市平桂高级中学(贺州市第五高级中学)2020-2021学年高二上学期第一次月考化学试题四川省平昌县驷马中学2020-2021学年下学期高二第一次月考化学试题贵州省黔西南州同源中学2020-2021学年高二上学期期中教学质量检测化学试题新疆乌鲁木齐市第八中学2019-2020学年高二上学期第三次月考化学试题河南省平顶山市鲁山县第一高级中学2021-2022学年高二上学期10月考试化学试题新疆疏附县第一中学2022-2023学年高二上学期期中考试化学试题吉林省白城市第十四中学2021-2022学年高二上学期期中考试化学试卷题
名校
解题方法
10 . 下列说法正确的是
| A.热化学方程式的计量数可以表示分子的个数 | B.热化学方程式中只需标明生成物的状态 |
| C.反应热指的是反应过程中放出或吸收的热量 | D.伴随能量变化的不一定是化学变化 |
您最近一年使用:0次
2023-10-26更新
|
45次组卷
|
2卷引用:天津市第四十七中学2023-2024学年高二上学期10月月考化学试题



