1 . 下列图示与对应的叙述相符的是( )
A.图1表示某恒温密闭容器中反应CaCO3(s) CaO(s)+CO2(g)达到平衡后,t1时刻压缩容器体积,CO2的物质的量浓度随时间的变化 CaO(s)+CO2(g)达到平衡后,t1时刻压缩容器体积,CO2的物质的量浓度随时间的变化 |
B.图2表示Ksp=1.0×10-12的CdCO3饱和溶液中,c(Cd2+)与c(CO32-)的关系曲线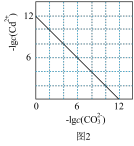 |
C.图3表示其他条件一定时,反应2SO2(g)+O2(g) 2SO3(g)在有、无催化剂条件下SO3的物质的量随时间的变化曲线 2SO3(g)在有、无催化剂条件下SO3的物质的量随时间的变化曲线 |
D.图4表示燃烧热为285.8kJ·mol-1的H2燃烧时能量的变化 |
您最近一年使用:0次
11-12高一下·河北衡水·期末
名校
解题方法
2 . 下列依据热化学方程式得出的结论正确的是
| A.若 2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ·mol-1,则 H2 燃烧热为 241.8 kJ/mol |
| B.若 C(石墨,s) =C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4kJ/mol,则 20.0 g NaOH固体与稀盐酸完全中和,放出 28.7 kJ 的热量, |
| D.已知 2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则 ΔH1>ΔH2 |
您最近一年使用:0次
2020-04-15更新
|
480次组卷
|
26卷引用:2015-2016学年江苏省盐城市阜宁中学高二上学期期末选修化学试卷
2015-2016学年江苏省盐城市阜宁中学高二上学期期末选修化学试卷江苏省宜兴市张渚高级中学2020-2021学年高二下学期第一学段质量检测化学试题(已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2014届湖南省“五市十校”高三12月联合检测化学试卷(已下线)2014届湖北省孝感市高中三年级第一次统一考试化学试卷2015届山东省沂水县一中高三上学期12月月考化学试卷2015届山东省城阳一中高三期中统考化学试卷2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷2015-2016学年浙江省温州中学高二上期末化学试卷2015-2016学年四川省成都市龙泉一中高二下入学考试化学试卷(已下线)同步君 人教版 选修四 第一章 第二节 燃烧热 能源2016-2017学年河南省南阳一中高二上第一次月考化学卷2016-2017学年湖南省浏阳市第一中学高二上阶段性测试化学试卷浙江省温州中学2016-2017学年高二下学期期中考试化学试题安徽省淮北市第一中学2017-2018学年高二上学期第二次月考化学试题甘肃省会宁县第四中学2017-2018学年高二上学期期中考试化学试题山东省新泰二中、泰安三中、宁阳二中2017-2018学年高二上学期期中联考化学试卷高中化学人教版 选修四 第一章 化学反应与能量 第二节 燃烧热 能源河南省安阳市第三十六中学2018-2019学年高二上学期第一次月考化学试题2020届高三化学二轮冲刺新题专练——燃烧热的定义与应用天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题山西省新绛县第二中学2019-2020学年高二上学期第一次考试化学试题湖南省常德外国语学校2020-2021学年高二上学期期中考试化学试题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题江西省吉安市永新中学2021-2022学年高二上学期期中考试化学(理科)试题6.2.2燃料燃烧释放的能量(课后)-2019苏教版必修2课前课中课后
解题方法
3 . 已知:①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1;
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
②C(s)+O2(g)=CO2(g) ΔH2;
③2H2(g)+O2(g)=2H2O(l) ΔH3;
④2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) ΔH4;
⑤2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH5。
下列关于上述反应焓变的判断正确的是( )
| A.ΔH1>0,ΔH2<0 | B.ΔH5=2ΔH2+ΔH3-ΔH1 |
| C.ΔH1<0,ΔH3<0 | D.ΔH4=ΔH1-2ΔH3 |
您最近一年使用:0次
4 . 下列说法中,正确的是( )
| A.ΔH>0 kJ/mol表示放热反应,ΔH<0 kJ/mol表示吸热反应 |
| B.1mol H2SO4与1mol Ba(OH)2反应时放出的热叫做中和热 |
| C.1mol H2与0.5molO2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数表示物质的量,所以可以是分数 |
您最近一年使用:0次
2020-03-02更新
|
172次组卷
|
10卷引用:江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题
江苏省常州市2022-2023学年高二下学期3月联合调研考试化学试题(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷(已下线)2011-2012学年四川省成都市六校协作体高二下学期期中联考化学试卷(已下线)2012-2013学年吉林省长春外国语学校高二第二次月考化学试卷2016-2017学年黑龙江省鸡西市第十九中学高二上学期期末考试化学试卷河南省平顶山市郏县第一高级中学2017-2018学年高二上学期第一次月考化学试题甘肃省张掖市2019—2020学年高二上学期期末学业水平质量检测化学试题甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期末考试化学试题湖北省武汉市第四中学2023-2024学年高二上学期10月月考化学试题
名校
解题方法
5 . 已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ⋅mol-1
(2)C(s)+O2(g)=CO2(g) △H2=-393.5kJ⋅mol-1
(3)H2(g)+ O2(g)=H2O(l) △H3=-285.8kJ⋅mol-1
O2(g)=H2O(l) △H3=-285.8kJ⋅mol-1
则下列反应的反应热为
2C(s)+2H2(g)+O2(g)=CH3COOH(l)
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ⋅mol-1
(2)C(s)+O2(g)=CO2(g) △H2=-393.5kJ⋅mol-1
(3)H2(g)+
 O2(g)=H2O(l) △H3=-285.8kJ⋅mol-1
O2(g)=H2O(l) △H3=-285.8kJ⋅mol-1则下列反应的反应热为
2C(s)+2H2(g)+O2(g)=CH3COOH(l)
| A.△H=+488.3kJ⋅mol-1 | B.△H=-244.15kJ⋅mol-1 |
| C.△H=-977.6kJ⋅mol-1 | D.△H=-488.3kJ⋅mol-1 |
您最近一年使用:0次
2020-02-13更新
|
218次组卷
|
9卷引用:江苏省南菁高级中学2020-2021学年高二上学期第一次阶段性考试化学试题
江苏省南菁高级中学2020-2021学年高二上学期第一次阶段性考试化学试题湖北省恩施州清江外国语学校2019-2020学年高二上学期期末考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】2020届高三化学知识点强化训练—化学能与热能四川省武胜烈面中学校2019-2020学年高二下学期开学考试化学试题重庆市万州纯阳中学2020-2021学年高二上学期期中考试化学试题重庆两江新区西大附中2021-2022学年高二上学期(秋季)开学考试化学试题新疆乌鲁木齐市第二十中学2019-2020学年高二上学期期中考试化学试题黑龙江省哈尔滨市第一六二中学校2022-2023学年高二上学期第一次月考化学试题
6 . 下列图示关系中不正确的是( )
A.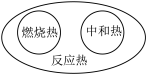 | B.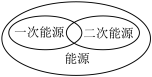 |
C.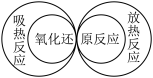 | D. |
您最近一年使用:0次
2020-01-28更新
|
336次组卷
|
8卷引用:2015-2016学年江苏省宿迁市沭阳县高二下学期期中考试化学试卷
解题方法
7 . 下列描述中正确的是
| A.反应2H2(g)+O2(g) =2H2O(g)的ΔH可通过下式估算: ∆H=反应中断裂旧共价键的键能之和-反应中形成新共价键的键能之和 |
| B.在25 ℃、101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热 |
| C.从C(石墨,s) = C(金刚石,s) ΔH=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
| D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
您最近一年使用:0次
2019-11-24更新
|
94次组卷
|
2卷引用:江苏省苏北县2019-2020学年高二上学期学情调研化学(选择考)试题
名校
8 . 研究化学反应中的能量变化有利于更好的开发和使用化学能源。
(1)金属镁[Mg(s)]分别与卤素单质[F2(g)、Cl2(g)、Br2(l)、I2(s)]反应的能量变化如图所示。
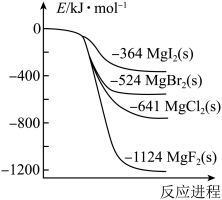
①写出Mg(s)和I2(s)反应的热化学方程式:_______ 。
②反应:MgCl2(s)+F2 (g)=MgF2(s)+Cl2 (g)的ΔH=___________ 。
(2)CH4用NiO作载氧体的化学链燃烧示意图如图所示。
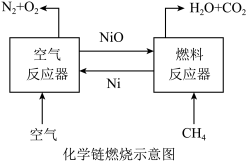
主要热化学反应如下:2Ni(s)+O2(g)=2NiO(s) ΔH=-479.8 kJ·mol-1;CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ΔH=+68.9 kJ·mol-1
①CH4的燃烧热是_______ 。
②CH4的“化学链燃烧”有利于二氧化碳的分离与回收,所放出的热量在相同条件下与CH4的直接燃烧相比_________ (填“前者大”、“后者大”、或“相同”)。
(3)已知H2、CO的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,25℃时,4 g H2和28 g CO的混合气体充分燃烧,恢复至原温,能放出的热量为_______ kJ。
(1)金属镁[Mg(s)]分别与卤素单质[F2(g)、Cl2(g)、Br2(l)、I2(s)]反应的能量变化如图所示。

①写出Mg(s)和I2(s)反应的热化学方程式:
②反应:MgCl2(s)+F2 (g)=MgF2(s)+Cl2 (g)的ΔH=
(2)CH4用NiO作载氧体的化学链燃烧示意图如图所示。

主要热化学反应如下:2Ni(s)+O2(g)=2NiO(s) ΔH=-479.8 kJ·mol-1;CH4(g)+4NiO(s)=CO2(g)+2H2O(l)+4Ni(s) ΔH=+68.9 kJ·mol-1
①CH4的燃烧热是
②CH4的“化学链燃烧”有利于二氧化碳的分离与回收,所放出的热量在相同条件下与CH4的直接燃烧相比
(3)已知H2、CO的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1,25℃时,4 g H2和28 g CO的混合气体充分燃烧,恢复至原温,能放出的热量为
您最近一年使用:0次
2019-10-29更新
|
192次组卷
|
2卷引用:江苏省如皋中学2019~2020学年度高二第一学期教学质量调研化学(选修)试题
解题方法
9 . 化学反应原理对化学反应的研究具有指导意义。
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A_____ ;B______ 。
②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?____ (选填“能”或“不能”),依据是____ 。
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+ I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向____ (选填“正反应”或“逆反应”)方向移动。请设计一种使该反应的化学平衡逆向移动的简单的实验方案____ 。
(3)已知:①CH3OH(g)+ O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是______
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为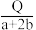 mol
mol
(1)机动车废气排放已成为城市大气污染的重要来源。
①气缸中生成NO的反应为:N2(g)+O2(g)
 2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A
2NO(g)△H>0。汽车启动后,气缸内温度越高,单位时间内NO排放量越大,请分析两点原因。A②汽车汽油不完全燃烧时还产生CO,若设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H>0,该设想能否实现?
(2)一定条件下,Fe3+和I﹣在水溶液中的反应是2I﹣+2Fe3+
 I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向
I2+2Fe2+,当反应达到平衡后,加入CCl4充分振荡,且温度不变,上述平衡向(3)已知:①CH3OH(g)+
 O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-akJ·mol-1②CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-bkJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-ckJ·mol-1
则下列叙述正确的是
A.由上述热化学方程式可知b>c
B.甲烷的燃烧热为bkJ·mol-1
C.2CH3OH(g)=2CH4(g)+O2(g) ΔH=2(b-a)kJ·mol-1
D.若甲醇和甲烷的物质的量之比为1∶2,其完全燃烧生成CO2和H2O(l)时放出的热量为QkJ,则该混合物中甲醇的物质的量为
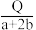 mol
mol
您最近一年使用:0次
10 . 下列依据热化学方程式得出的结论正确的是
A.已知2SO2(g)+O2(g) 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 |
| B.若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定 |
| C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 |
| D.已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2 |
您最近一年使用:0次
2019-10-09更新
|
248次组卷
|
5卷引用:江苏省连云港市厉庄高级中学2022-2023学年高三上学期第一次质量检测化学试题



