名校
1 . 已知 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。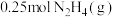 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出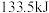 热量。则下列热化学方程式书写正确的是
热量。则下列热化学方程式书写正确的是
 是一种高效清洁的火箭燃料。
是一种高效清洁的火箭燃料。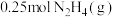 完全燃烧生成
完全燃烧生成 和
和 时,放出
时,放出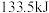 热量。则下列热化学方程式书写正确的是
热量。则下列热化学方程式书写正确的是A. |
B.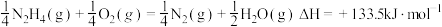 |
C.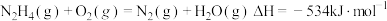 |
D. |
您最近一年使用:0次
解题方法
2 . 下列有关热化学方程式说法不正确的是
A.已知  , ,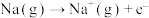  则 则 |
B.表示 的燃烧热: 的燃烧热: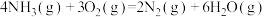  |
C.一定条件下 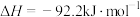 ,则 ,则 和 和 置于密闭容器中充分反应放热小于 置于密闭容器中充分反应放热小于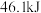 |
D.已知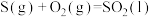  , ,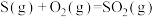  ,则 ,则 |
您最近一年使用:0次
解题方法
3 . 下列热化学方程式正确的是
A.通常状况下,将1 g氢气在氯气中完全燃烧,放出92.4 kJ热量: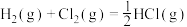 ; ;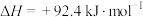 |
B.已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出b kJ热量: ; ;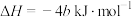 |
C.1 g炭与适量水蒸气反应生成一氧化碳和氢气,需吸收10.94 kJ的热量: 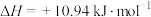 |
D.已知甲烷燃烧生成二氧化碳和液态水放出的热量为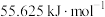 : : ; ; |
您最近一年使用:0次
名校
解题方法
4 . 下列依据热化学方程式得出的结论正确的是
A.已知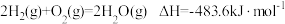 ;则氢气的燃烧热为 ;则氢气的燃烧热为 |
B.已知 ;则金刚石比石墨稳定 ;则金刚石比石墨稳定 |
C.已知 ;则含 ;则含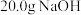 的稀溶液与稀盐酸完全中和,放出 的稀溶液与稀盐酸完全中和,放出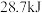 的热量 的热量 |
D.已知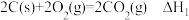 , ,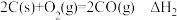 ;则 ;则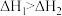 |
您最近一年使用:0次
2024-01-09更新
|
234次组卷
|
37卷引用:广东省佛山市实验中学2022-2023学年高二上学期第一次段考化学试题
广东省佛山市实验中学2022-2023学年高二上学期第一次段考化学试题广东省湛江市第二十一中学2023-2024学年高二10月月考化学试题广东省广州市真光中学2023-2024学年高二上学期12月月考化学试题广东省江门市鹤山市第一中学2023-2024学年高二上学期第二阶段考试化学试题广东省梅州市梅雁中学2023-2024学年高二上学期12月月考化学试题(已下线)2015届广西桂林市第十八中学高三上学期第二次月考化学试卷山西省朔州市怀仁一中2018-2019学年高二上学期第三次月考化学试题江苏省南菁高级中学2020-2021学年度高二上学期第一次阶段性考试化学(强化班)试题内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题黑龙江省双鸭山市第一中学2022-2023学年高二10月月考化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题北京市顺义牛栏山第一中学2022-2023学年高二上学期10月月考化学试题湖南省永州市宁远县明德湘南中学2022-2023学年高二上学期第一次月考化学试题广东番禺中学2022-2023学年高二上学期期末测试化学试题四川省南充高级中学2023-2024学年高二上学期10月月考化学试题黑龙江省鹤岗市第三中学2023-2024学年高二上学期10月月考化学试题福建省厦门市松柏中学2023-2024学年高二上学期10月月考化学试题四川省绵竹中学2023-2024学年高二上学期第二次月考化学试题四川省阆中东风中学校2023-2024学年高二上学期第二次段考化学试题四川省绵阳南山中学实验学校2023-2024学年高二上学期12月月考化学试题天津市南蔡村中学2023-2024学年高二上学期第二次月考化学试卷山东省威海大光华学校2023-2024学年高二11月月考化学试题河北省深州中学2016-2017学年高一下学期期末考试化学试题安徽省定远县第三中学2018-2019学年度下学期高二化学开学检测卷【全国百强校】内蒙古自治区鄂尔多斯市第一中学2018-2019学年高一下学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高二上学期期中考试化学试题北京市第三十一中学2021-2022学年高二上学期期中考试化学试题河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题河南省郑州外国语学校2022-2023学年高二上学期期中考试化学试题黑龙江省肇东市第四中学2022-2023学年高二上学期期末考试化学试题湖南省长沙市第一中学2022-2023学年高二下学期入学考试化学试题 河南省南阳市2022-2023学年高二上学期期终质量评估化学试题辽宁省名校联盟2023-2024学年高二上学期期初考试化学试题辽宁省锦州市黑山县名校联盟试2023-2024学年高二上学期开学考试化学试题江西省九江市庐山市第一中学2022-2023学年高二上学期期末考试化学试题辽宁省辽西联合校2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)
| 选项 | 已知条件 | 热化学方程式 |
| A |  的燃烧热数值为a kJ/mol 的燃烧热数值为a kJ/mol | 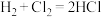 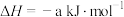 |
| B | 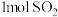 与足量 与足量 充分反应后,放出热量 充分反应后,放出热量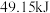 |  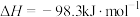 |
| C |   | 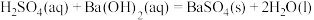 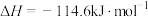 |
| D | 31g白磷比31g红磷能量多b kJ |  , ,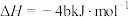 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-19更新
|
246次组卷
|
8卷引用:广东省佛山市三水中学2022-2023学年高二上学期10月第一次统测化学试题
解题方法
6 . 下列有关热化学方程式的说法正确的是
A.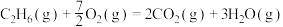 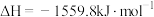 ,则 ,则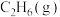 的燃烧热为 的燃烧热为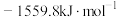 |
B.已知  ,则 ,则 和 和 充分反应放出热量 充分反应放出热量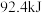 |
C.已知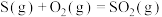  , ,  ,则 ,则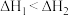 |
D.已知  , ,  ,则 ,则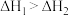 |
您最近一年使用:0次
名校
7 . 完成下列问题。
(1)在 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为___________ 。
(2)现有反应: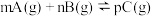 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
①该反应的逆反应为___________ 热反应,且
___________ p(填“>”、“=”或“<”)。
②减压时,A的质量分数___________ 。(填“增大”、“减小”或“不变”,下同)
③若加入B(体积不变),则A的转化率___________ 。
④若升高温度,则平衡时B、C的浓度之比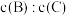 将
将___________ 。
⑤若加入催化剂,平衡时气体混合物的总物质的量___________ 。
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色___________ ;(填“变深”、“变浅”或“不变”,下同)维持容器内压强不变,充入氖气后,混合物颜色___________ 。
(3)已知相同条件下
反应I:
反应Ⅱ:
则反应
___________ 。(用 表示)。
表示)。
(1)在
 时,
时, 在足量的氧气中充分燃烧生成二氧化硫,放出
在足量的氧气中充分燃烧生成二氧化硫,放出 的热量,则表示S的燃烧热的热化学方程式为
的热量,则表示S的燃烧热的热化学方程式为(2)现有反应:
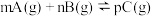 ,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
,达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:①该反应的逆反应为

②减压时,A的质量分数
③若加入B(体积不变),则A的转化率
④若升高温度,则平衡时B、C的浓度之比
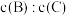 将
将⑤若加入催化剂,平衡时气体混合物的总物质的量
⑥若B是有色物质,A、C均无色,则加入C(体积不变)后混合物颜色
(3)已知相同条件下
反应I:

反应Ⅱ:

则反应

 表示)。
表示)。
您最近一年使用:0次
名校
8 . 填空。
(1)在25℃、 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量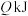 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得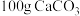 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为______ 。
(2)如图1是反应 在不同温度下CO的转化率随时间变化的曲线。
在不同温度下CO的转化率随时间变化的曲线。
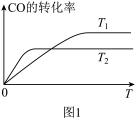
①T1和T2温度下的平衡常数大小关系是K1______ (填“>”“<”或“=”)K2。在T1温度下,往体积为1L的密闭容器中,充入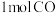 和
和 ,经测得CO和
,经测得CO和 的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
______ (保留两位小数),达平衡时CO的转化率为______ ,该反应的平衡常数为______ 。
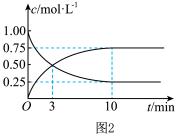
②若容器容积不变,下列措施可增加CO转化率的是______ (填字母)。
a.升高温度
b.将 从体系中分离
从体系中分离
c.使用合适的催化剂
d.充入He,使体系总压强增大
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为 )与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
)与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。______ 。

(1)在25℃、
 下,一定质量的无水乙醇完全燃烧时放出热量
下,一定质量的无水乙醇完全燃烧时放出热量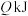 ,其燃烧生成的
,其燃烧生成的 用过量饱和石灰水吸收可得
用过量饱和石灰水吸收可得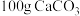 沉淀,则乙醇燃烧的热化学方程式为
沉淀,则乙醇燃烧的热化学方程式为(2)如图1是反应
 在不同温度下CO的转化率随时间变化的曲线。
在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1
 和
和 ,经测得CO和
,经测得CO和 的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率
的浓度随时间变化如图2所示。则0~3min内,以CO表示的该反应速率

②若容器容积不变,下列措施可增加CO转化率的是
a.升高温度
b.将
 从体系中分离
从体系中分离c.使用合适的催化剂
d.充入He,使体系总压强增大
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图3是上述三种温度下H2和CO的起始组成比(起始时CO的物质的量均为
 )与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
)与CO平衡转化率的关系,曲线上a、b、c点对应的化学平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为。
您最近一年使用:0次
名校
9 . 现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请回答以下问题:
(1)理想的新能源应具有资源丰富、可以再生、对环境无污染等特点,下列属于理想的新能源的是________ 。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
(2)已知:CO的燃烧热为283kJ/mol,则表示CO燃烧热的热化学方程式为:________ 。
(3)已知反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+198kJ•mol-1,在298K时断开(形成)1mol化学键要吸收(放出)的能量数据为:
则根据反应热的计算,x=________ 。
(4)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:
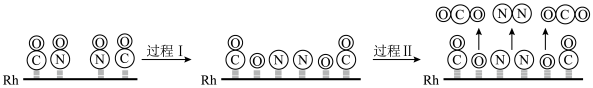
①过程I为过程_______ (填“吸热”或“放热”。过程II生成的化学键有________ (填“极性键”、“非极性键”或“极性键”和“非极性键”)。
②已知过程I的焓变为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为________ 。
(5)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式________ 。
(1)理想的新能源应具有资源丰富、可以再生、对环境无污染等特点,下列属于理想的新能源的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
(2)已知:CO的燃烧热为283kJ/mol,则表示CO燃烧热的热化学方程式为:
(3)已知反应CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+198kJ•mol-1,在298K时断开(形成)1mol化学键要吸收(放出)的能量数据为:
| 化学键 | H-H | O-H | C-H | C≡O |
| E/(kJ•mol-1) | 436 | x | 413 | 1076 |
(4)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如图:

①过程I为过程
②已知过程I的焓变为akJ/mol,过程II的焓变为bkJ/mol,则该反应的热化学方程式为
(5)火箭发射时可以用肼(N2H4,液态)作燃料,NO2作氧化剂,二者反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g) △H1=+66.4kJ•mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ•mol-1
请写出N2H4(l)与NO2反应的热化学方程式
您最近一年使用:0次
名校
解题方法
10 . 完成下列问题
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;
 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为___________ 。
(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式___________ 。
(3)已知:N2(g)+O2(g) 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1
C(s)+O2(g) CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣1
2C(s)+O2(g) 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1
请写出NO和CO生成N2和CO2的热化学方程式___________ 。
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是___________ 。
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及___________ 。
③倒入NaOH和盐酸溶液的正确操作是___________ (填字母)。
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=___________ (结果保留一位小数)。
⑤该同学通过实验测出的中和热有误差,造成这一结果的原因不可能的是 ___________ 。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
(1)煤油的主要成分为C12H26,已知34g C12H26完全燃烧生成气态水时放出1386.2kJ热量;

 。则表示煤油燃烧热的热化学方程式为
。则表示煤油燃烧热的热化学方程式为(2)已知甲烷能催化还原NO2,得到氮气、二氧化碳和水蒸气,且知反应消耗1.6 g甲烷时,放出热量86.7 kJ,写出甲烷催化还原NO2的热化学方程式
(3)已知:N2(g)+O2(g)
 2NO(g) ΔH1=+180.5kJ•mol﹣1
2NO(g) ΔH1=+180.5kJ•mol﹣1C(s)+O2(g)
 CO2(g) ΔH2=﹣393.5kJ•mol﹣1
CO2(g) ΔH2=﹣393.5kJ•mol﹣12C(s)+O2(g)
 2CO(g) ΔH3=﹣221.0kJ•mol﹣1
2CO(g) ΔH3=﹣221.0kJ•mol﹣1请写出NO和CO生成N2和CO2的热化学方程式
(4)利用如图所示装置测定中和热的实验步骤如下,回答下列问题:

步骤一:用量筒量取100mL 0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
步骤二:用另一量筒量取100mL 0.55mol·L-1 NaOH溶液,并用同一温度计测出其温度;
步骤三:将NaOH和盐酸溶液一并倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
①仪器a的名称是
②配制100mL 0.55mol/L的氢氧化钠溶液,需要用到的仪器有托盘天平(附砝码)、烧杯、药匙、镊子、玻璃棒、量筒、胶头滴管以及
③倒入NaOH和盐酸溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入
C.一次迅速倒入 D.一边搅拌一边滴入
④假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:依据该学生的实验数据计算,该实验测得的中和热ΔH=
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.2 | 23.3 |
| 2 | 20.2 | 20.4 | 23.5 |
| 3 | 20.3 | 20.5 | 25.6 |
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入小烧杯中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
您最近一年使用:0次
2023-10-30更新
|
156次组卷
|
3卷引用:广东省普宁市勤建学校2023-2024学年高二上学期第二次月考化学试题



