名校
解题方法
1 . 我国含硫天然气资源丰富,甲烷与硫化氢重整制氢和天然气脱硫具有重要的现实意义。甲烷与硫化氢重整制氢反应为 ,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为:
,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为: 在
在_____ 下可自发进行。
A.高温 B.低温
在恒压条件下,起始时按 (同时通入一定量的
(同时通入一定量的 进行稀释,
进行稀释, 不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中 、
、 、
、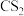 、
、 的物质的量分数
的物质的量分数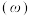 的影响如图所示:
的影响如图所示: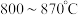 温度区间内,随温度升高,
温度区间内,随温度升高, 在平衡时反应混合物中含量迅速下降,而
在平衡时反应混合物中含量迅速下降,而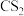 的含量几乎为0,根据图2分析其可能的原因是
的含量几乎为0,根据图2分析其可能的原因是_____ 。
(3)已知每1克 燃烧放热
燃烧放热 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_____ 。
 ,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为:
,其过程中反应ⅰ、ⅱ及其相对能量变化示意图为: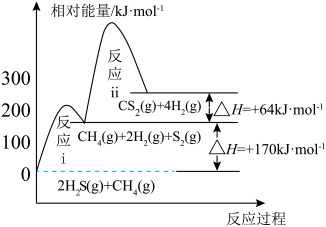
 在
在A.高温 B.低温
在恒压条件下,起始时按
 (同时通入一定量的
(同时通入一定量的 进行稀释,
进行稀释, 不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中
不参与反应)向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中 、
、 、
、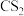 、
、 的物质的量分数
的物质的量分数 的影响如图所示:
的影响如图所示: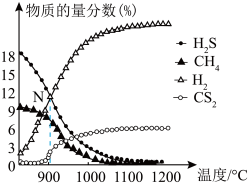
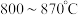 温度区间内,随温度升高,
温度区间内,随温度升高, 在平衡时反应混合物中含量迅速下降,而
在平衡时反应混合物中含量迅速下降,而 的含量几乎为0,根据图2分析其可能的原因是
的含量几乎为0,根据图2分析其可能的原因是(3)已知每1克
 燃烧放热
燃烧放热 ,则表示
,则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 硅是重要的半导体材料,构成现代电子工业的基础。磷及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。在工业上,高纯硅可以通过下列流程制取:
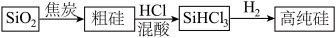
(1)基态硅原子核外电子的运动状态有___________ 种,占据的最高能层符号为___________ 。
(2)流程中由 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是___________ 。请写出一个能说明碳的非金属性强于硅的化学方程式___________ 。
(3) 甲硅烷 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:___________ 。
(4) 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是___________ 。
(5)工业上硅铁可以用于冶镁。以煅白 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于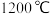 发生反应:
发生反应: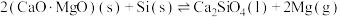 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:___________ 。
(6)有关碳和硅的有关化学键链能如下所示。
硅也有系列氢化物,如甲硅烷等。但硅烷在种类和数量上都远不如烷烃多,原因是___________ 。

(1)基态硅原子核外电子的运动状态有
(2)流程中由
 制粗硅的反应不能说明碳的非金属性强于硅,原因是
制粗硅的反应不能说明碳的非金属性强于硅,原因是(3) 甲硅烷
 是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,
是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下, 自燃放出热量
自燃放出热量 ,请写出其燃烧的热化学方程式:
,请写出其燃烧的热化学方程式:(4)
 的热稳定性不如
的热稳定性不如 ,其原因是
,其原因是(5)工业上硅铁可以用于冶镁。以煅白
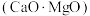 为原料与硅铁(含硅
为原料与硅铁(含硅 的硅铁合金)混合,置于密闭设备中于
的硅铁合金)混合,置于密闭设备中于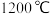 发生反应:
发生反应: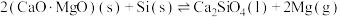 ,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:
,已知常温下镁的还原性强于硅。利用平衡移动原理解释上述方法能够获得镁的原因:(6)有关碳和硅的有关化学键链能如下所示。
| 化学键 |  |  |  |  |  |  |
键能/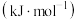 | 356 | 413 | 336 | 226 | 318 | 452 |
您最近一年使用:0次
名校
3 . 回答下列问题。
(1)下列变化过程,属于放热是___________ 。
A.碳酸钙分解 B.氢气在氯气中燃烧 C.Ba(OH)2·8H2O与NH4Cl
D.铝热反应 E.酸碱中和反应 F.FeCl3水解
(2)①C(s)+O2(g)=CO2(g) =-437.3kJ/mol
=-437.3kJ/mol
②H2(g)+ O2(g)=H2O(g)
O2(g)=H2O(g)  =-285.8 kJ/mol
=-285.8 kJ/mol
③CO(g)+ O2(g)=CO2(g)
O2(g)=CO2(g)  =-283.0 kJ/mol
=-283.0 kJ/mol
固态碳和水蒸气反应生成CO和H2的热化学方程式为___________ 。
(3)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热 为
为___________ 。
(4)标准状况下,3.36L仅由C、H元素组成的某气体质量4.5g完全燃烧生成CO2(g)和H2O(l)时,放出233.97kJ的热量。该气体的分子式为___________ ,热值为___________ kJ/g,该气体燃烧热的热化学方程式为___________ 。
(1)下列变化过程,属于放热是
A.碳酸钙分解 B.氢气在氯气中燃烧 C.Ba(OH)2·8H2O与NH4Cl
D.铝热反应 E.酸碱中和反应 F.FeCl3水解
(2)①C(s)+O2(g)=CO2(g)
 =-437.3kJ/mol
=-437.3kJ/mol②H2(g)+
 O2(g)=H2O(g)
O2(g)=H2O(g)  =-285.8 kJ/mol
=-285.8 kJ/mol③CO(g)+
 O2(g)=CO2(g)
O2(g)=CO2(g)  =-283.0 kJ/mol
=-283.0 kJ/mol固态碳和水蒸气反应生成CO和H2的热化学方程式为
(3)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热
 为
为| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
A.同温同压下, 在光照和点燃条件下的 在光照和点燃条件下的 相同 相同 |
B.已知 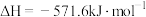 ,则 ,则 的燃烧热为 的燃烧热为 |
C.一定条件下,将 置于密闭容器中充分反应生成 置于密闭容器中充分反应生成 和 和 ,吸收热量19.3kJ,其热化学方程式可表示为 ,吸收热量19.3kJ,其热化学方程式可表示为 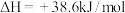 |
D.在稀溶液中: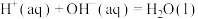 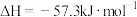 ,若将含1molHCl的盐酸与含 ,若将含1molHCl的盐酸与含 的氨水混合,放出的热量等于57.3kJ 的氨水混合,放出的热量等于57.3kJ |
您最近一年使用:0次
2023-11-14更新
|
184次组卷
|
2卷引用:上海市建平世纪中学2023-2024学年高二上学期阶段练习二 化学(等级)试题
名校
5 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛前景。回答问题:
(1)汽油的主要成分之一是液态辛烷(C8H18),25℃,101kPa时,0.2mol辛烷完全燃烧生成二氧化碳气体和液态水,放出1103.6kJ热量。写出表示辛烷燃烧热的热化学方程式______ 。
(2)常温常压下 ,相同质量的甲醇和辛烷分别燃烧释放的热量用于煅烧石灰石,得到CaO多的是
,相同质量的甲醇和辛烷分别燃烧释放的热量用于煅烧石灰石,得到CaO多的是______ (填“甲醇”或“辛烷”)。
(1)汽油的主要成分之一是液态辛烷(C8H18),25℃,101kPa时,0.2mol辛烷完全燃烧生成二氧化碳气体和液态水,放出1103.6kJ热量。写出表示辛烷燃烧热的热化学方程式
(2)常温常压下
 ,相同质量的甲醇和辛烷分别燃烧释放的热量用于煅烧石灰石,得到CaO多的是
,相同质量的甲醇和辛烷分别燃烧释放的热量用于煅烧石灰石,得到CaO多的是
您最近一年使用:0次
名校
解题方法
6 . 联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气, 并放出大量热。已知0.5mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8kJ的热量。
(1)肼的结构式为___________ ,其中氮的化合价为___________ 。
(2)写出反应的热化学方程式:___________ 。
(3)在25℃、101kPa时,已知18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下:
①写出表示H2燃烧热的热化学方程式___________ ;
②则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是___________ ;
③联氨和H2O2可作为火箭推进剂的主要原因为___________ 。
(4)①2O2(g)+N2(g)=N2O4(l)
②N2(g)+2H2(g)=N2H4(l)
③O2(g)+2H2(g)=2H2O(g)
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)
上述反应热效应之间的关系式为 =
=___________ (用 、
、 、
、 表示)。
表示)。
(5)已知:N2(g)+2O2(g)=2NO2(g) =+66.4kJ/mol
=+66.4kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) =-534kJ/mol
=-534kJ/mol
H2O(g)=H2O(l) =-44.0kJ/mol
=-44.0kJ/mol
则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l) =
=___________ 。
(1)肼的结构式为
(2)写出反应的热化学方程式:
(3)在25℃、101kPa时,已知18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下:
| O=O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | 463 |
②则32g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是
③联氨和H2O2可作为火箭推进剂的主要原因为
(4)①2O2(g)+N2(g)=N2O4(l)

②N2(g)+2H2(g)=N2H4(l)

③O2(g)+2H2(g)=2H2O(g)

④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)

上述反应热效应之间的关系式为
 =
= 、
、 、
、 表示)。
表示)。(5)已知:N2(g)+2O2(g)=2NO2(g)
 =+66.4kJ/mol
=+66.4kJ/molN2H4(l)+O2(g)=N2(g)+2H2O(g)
 =-534kJ/mol
=-534kJ/molH2O(g)=H2O(l)
 =-44.0kJ/mol
=-44.0kJ/mol则2N2H4(l)+2NO2(g)=3N2(g)+4H2O(l)
 =
=
您最近一年使用:0次
名校
7 . 完成下列问题
(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜) S(s,斜方) ΔH=-0.398kJ·mol−1,则S(单斜)与S(斜方)相比,较稳定的是
S(s,斜方) ΔH=-0.398kJ·mol−1,则S(单斜)与S(斜方)相比,较稳定的是___________ [填“S(单斜)”或“S(斜方)”]。
(2)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1mol产物的数据)。

写出表示S8燃烧热的热化学方程式:___________ 。
(1)S8分子可形成单斜硫和斜方硫,转化过程如下:S(s,单斜)
 S(s,斜方) ΔH=-0.398kJ·mol−1,则S(单斜)与S(斜方)相比,较稳定的是
S(s,斜方) ΔH=-0.398kJ·mol−1,则S(单斜)与S(斜方)相比,较稳定的是(2)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)。反应过程和能量关系可用如图简单表示(图中的ΔH表示生成1mol产物的数据)。

写出表示S8燃烧热的热化学方程式:
您最近一年使用:0次
名校
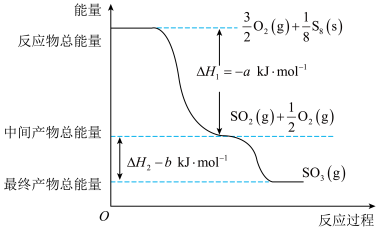
8 . 25℃、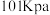 、
、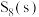 和
和 发生反应依次转化为
发生反应依次转化为 和
和 。反应过程和能量关系可用如图简单表示(图中的
。反应过程和能量关系可用如图简单表示(图中的 表示生成
表示生成 产物的数据),已知:
产物的数据),已知:
①
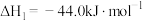 ;
;
②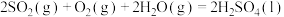
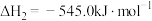 ;
;
(1)结合能量图,书写 与
与 反应生成
反应生成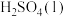 的热化学方程式是
的热化学方程式是___________ 。
(2)计算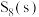 的燃烧热值为
的燃烧热值为___________ 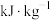 。
。
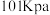 、
、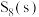 和
和 发生反应依次转化为
发生反应依次转化为 和
和 。反应过程和能量关系可用如图简单表示(图中的
。反应过程和能量关系可用如图简单表示(图中的 表示生成
表示生成 产物的数据),已知:
产物的数据),已知:
①

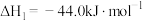 ;
;②
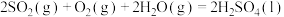
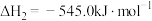 ;
;(1)结合能量图,书写
 与
与 反应生成
反应生成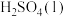 的热化学方程式是
的热化学方程式是(2)计算
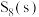 的燃烧热值为
的燃烧热值为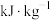 。
。
您最近一年使用:0次
名校
9 . 25℃、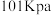 时,
时, 的燃烧热为
的燃烧热为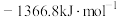 ,写出乙醇燃烧热的热化学方程式:
,写出乙醇燃烧热的热化学方程式:___________ 。
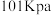 时,
时, 的燃烧热为
的燃烧热为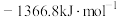 ,写出乙醇燃烧热的热化学方程式:
,写出乙醇燃烧热的热化学方程式:
您最近一年使用:0次
名校
10 . 分析表中的3个热化学方程式,下列说法错误的是
| 2022年北京冬奥会“飞扬”火炬的燃料 | H2 | ①2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ•mol-1 |
| 2008年北京奥运会“祥云”火炬的燃料 | C3H8 | ②C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH=-2039kJ•mol-1 ③2C3H8(g)+7O2(g)=6CO(g)+8H2O(g) ΔH=-2380kJ•mol-1 |
| A.3CO(g)+7H2(g)=C3H8(g)+3H2O(g) ΔH=-504kJ•mol-1 |
| B.等质量的氢气与丙烷相比较,充分燃烧时,氢气放热更多 |
| C.3CO2(g)+10H2(g)=C3H8(g)+6H2O(g) ΔH=-381kJ•mol-1 |
| D.丙烷的燃烧热为-2039kJ•mol-1 |
您最近一年使用:0次
2023-03-19更新
|
265次组卷
|
2卷引用:上海市宜川中学2022-2023学年高二下学期3月阶段测试化学试题



