名校
解题方法
1 . 完成下列问题
(1)在 25℃、101 kPa 下,已知 SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol 电子放出热量 a kJ,该反应的热化学方程式为___________ 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,已知25℃、101kPa下C8H18(辛烷)的热值为b kJ/g,表示辛烷燃烧热的热化学方程式为___________ 。
(3)已知:H2O(l)= H2O(g) ΔH= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:___________ 。
②CO的燃烧热ΔH=___________ kJ·mol-1
③已知氢气的燃烧热为-286kJ·mol-1,氧气中O=O键的键能为496kJ·mol-1,水蒸气中H-O键的键能为463kJ·mol-1,则氢气中H-H键的键能为___________ kJ·mol-1。
(1)在 25℃、101 kPa 下,已知 SiH4气体在氧气中完全燃烧后恢复至原状态,平均每转移1 mol 电子放出热量 a kJ,该反应的热化学方程式为
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,已知25℃、101kPa下C8H18(辛烷)的热值为b kJ/g,表示辛烷燃烧热的热化学方程式为
(3)已知:H2O(l)= H2O(g) ΔH= +44.0kJ·mol-1,甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:
②CO的燃烧热ΔH=
③已知氢气的燃烧热为-286kJ·mol-1,氧气中O=O键的键能为496kJ·mol-1,水蒸气中H-O键的键能为463kJ·mol-1,则氢气中H-H键的键能为
您最近一年使用:0次
解题方法
2 . 回答下列问题:
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:_______ 。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
试根据表中所列键能数据估算a的数值_______ 。
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:_______ 。
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为_______ 。
(1)实验测得常温下16 g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出363.25 kJ的热量,试写出甲醇燃烧热的热化学方程式:
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键被破坏和生成物的化学键的形成过程。已知反应:N2(g)+3H2(g)⇌2NH3(g) △H=a kJ/mol。有关键能数据如下:
| 化学键 | H-H | N-H | N≡N |
| 键能(kJ/mol) | 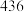 | 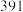 | 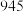 |
试根据表中所列键能数据估算a的数值
(3)用盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。已知:
C(s,石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599 kJ/mol
请写出由C(s,石墨)和H2(g)生成1 mol C2H2(g)的热化学方程式:
(4)某金属氧化物的化学式为M2O,电子总数为30,已知氧原子核内有8个中子,M2O的相对分子质量为62,则M原子核内中子数为
您最近一年使用:0次
解题方法
3 . 按要求写出相关内容
(1)已知:C(s)+O2(g)=CO2(g) △H= -393.5 kJ/mol
CO(g)+ O2(g)=CO2(g) △H= -283 kJ/mol
O2(g)=CO2(g) △H= -283 kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)放出的热量为_______ ,反应的热化学方程式为:_______ 。
(2)1 L 1 mol/LH2SO4溶液与2 L 1 mol/LNaOH溶液完全反应,放出114.6 kJ的热量,表示该中和热的热化学方程式为_______ 。
(1)已知:C(s)+O2(g)=CO2(g) △H= -393.5 kJ/mol
CO(g)+
 O2(g)=CO2(g) △H= -283 kJ/mol
O2(g)=CO2(g) △H= -283 kJ/mol则1 mol C(s)与O2(g)反应生成CO(g)放出的热量为
(2)1 L 1 mol/LH2SO4溶液与2 L 1 mol/LNaOH溶液完全反应,放出114.6 kJ的热量,表示该中和热的热化学方程式为
您最近一年使用:0次
4 . 完成下列问题
(1)已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+ O2(g)=CO(g)△H3=akJ/mol,则a=
O2(g)=CO(g)△H3=akJ/mol,则a=________ 。
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H1,下表所列数据是反应在不同温度下的化学平衡常数(K)
由表中数据判断△H1________ 0 (填“>”、“=”或“<”)。某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________ ,此时的温度为________ (从上表中选择)。
(1)已知C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol,
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ/mol,
C(s)+
 O2(g)=CO(g)△H3=akJ/mol,则a=
O2(g)=CO(g)△H3=akJ/mol,则a=(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)△H1,下表所列数据是反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1
您最近一年使用:0次
5 . (1)已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·L-1,断裂1molH-H键吸收的能量为436kJ,断裂1molO=O键吸收的能量为496kJ,则形成1molH-O键放出的能量为__ kJ。
(2)根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1)△H=-Q1kJ·L-1
2H2S(g)+O2(g)=2S(g)+2H2O(1)△H=-Q2kJ·L-1
2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-Q3kJ·L-1
判断Q1、Q2、Q3三者大小关系:__ 。
(3)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=bkJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=ckJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为__ 。
(4)若在常温常压下,lg乙醇(CH3CH2OH)完全燃烧生成二氧化碳和液态水放热约为30kJ的热量。写出乙醇燃烧热 的热化学方程式___ 。
(2)根据以下三个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(1)△H=-Q1kJ·L-1
2H2S(g)+O2(g)=2S(g)+2H2O(1)△H=-Q2kJ·L-1
2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-Q3kJ·L-1
判断Q1、Q2、Q3三者大小关系:
(3)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)=CH3OH(g) △H=akJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H=bkJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H=ckJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
(4)若在常温常压下,lg乙醇(CH3CH2OH)完全燃烧生成二氧化碳和液态水放热约为30kJ的热量。写出乙醇
您最近一年使用:0次
解题方法
6 . (1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下:
①ΔH1=______ kJ·mol−1。
②提高该反应平衡转化率的方法有______ 、______ 。
(2)钒催化剂参与反应的能量变化如下图所示,V2O5(s)与SO2(g)反应生VOSO4(s)和V2O4(s)的热化学方程式为:__ 。

物质 | C2H6(g) | C2H4(g) | H2(g) |
燃烧热ΔH/(kJ·mol−1) | -1560 | -1411 | -286 |
①ΔH1=
②提高该反应平衡转化率的方法有
(2)钒催化剂参与反应的能量变化如下图所示,V2O5(s)与SO2(g)反应生VOSO4(s)和V2O4(s)的热化学方程式为:

您最近一年使用:0次
7 . 甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________ 。
(2)反应②中的能量变化如下图所示,则△H2=______ (用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________ (写出一点)
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1(1)甲醇蒸汽完全燃烧的热化学方程式为
(2)反应②中的能量变化如下图所示,则△H2=

(3)H2(g)的燃烧热为
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:
您最近一年使用:0次
2020-01-12更新
|
182次组卷
|
8卷引用:陕西省西安市第26中2017-2018学年第一学期高二期中考试化学试卷.
解题方法
8 . 氢能的优点是燃烧热值高,无污染。目前工业制氢气的一个重要反应为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH,反应过程和能量的关系如图所示:
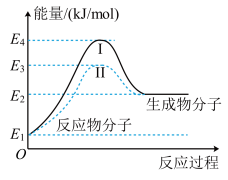
(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH______ (填“>”“<”或“=”)0。
(2)过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热________ (填“相等”或“不相等”),原因是____________________________________________________________________ 。
(3)已知:H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为_________________________________________ 。

(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH
(2)过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热
(3)已知:H2(g)+
 O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为
您最近一年使用:0次
2019-12-25更新
|
164次组卷
|
3卷引用:陕西省咸阳百灵中学2019-2020学年高二上学期第二次月考化学(理)试题
9 . Ⅰ.(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ ΔH2。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1

试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________ ,写出肼(l)和N2O4(l)反应的热化学方程式:___________________________________________________ 。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1

试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是
您最近一年使用:0次
2019-12-24更新
|
89次组卷
|
3卷引用:陕西省渭南韩城市2019-2020学年高二上学期期中考试化学试题
解题方法
10 . (1) 0.5 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出683.4 kJ热量,写出该反应的热化学方程式___________________ 。
(2)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)= 2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)= 2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)= 2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式__________________ 。
(3) “长征三号甲”三子级使用的燃料是液氢和液氧,下面是298 K时,氢气(H2)、氧气(O2)有关变化的反应热:
①H2(g)+O2(g)= H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)= H2(l) ΔH=-0.92 kJ·mol-1
③O2(g)= O2(l) ΔH=-6.84 kJ·mol-1
④H2O(g)= H2O(l) ΔH=-44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:____________ 。
(2)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)= 2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)= 2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)= 2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式
(3) “长征三号甲”三子级使用的燃料是液氢和液氧,下面是298 K时,氢气(H2)、氧气(O2)有关变化的反应热:
①H2(g)+O2(g)= H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)= H2(l) ΔH=-0.92 kJ·mol-1
③O2(g)= O2(l) ΔH=-6.84 kJ·mol-1
④H2O(g)= H2O(l) ΔH=-44.0 kJ·mol-1
请写出液氢和液氧反应生成气态水的热化学方程式:
您最近一年使用:0次



