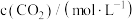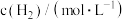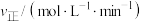解题方法
1 . 二甲醚 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
 .
.

 .
.

 .
.

回答下列问题:
(1)
___________ 。
(2)向初始温度为T℃的某恒容绝热容器中投入2mol 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。
①下列叙述能说明反应 已经达到平衡的是
已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
d. 的体积分数不再发生变化
的体积分数不再发生变化
②相同条件下,若向该容器中加入 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
___________ 1(填“>”“=”或“<”)。
③在催化剂条件下反应 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为___________ (填“第一步”或“第二步”),判断的理由是___________ 。
(3)向压强恒定为p kPa的某密闭容器中按 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示 随温度变化的曲线是
随温度变化的曲线是___________ (填“ ”或“
”或“ ”),原因为
”),原因为___________ 。
② K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字); K时反应
K时反应 的压强平衡常数
的压强平衡常数
___________  (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下: .
.

 .
.

 .
.

回答下列问题:
(1)

(2)向初始温度为T℃的某恒容绝热容器中投入2mol
 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。①下列叙述能说明反应
 已经达到平衡的是
已经达到平衡的是a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率d.
 的体积分数不再发生变化
的体积分数不再发生变化②相同条件下,若向该容器中加入
 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
③在催化剂条件下反应
 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为
(3)向压强恒定为p kPa的某密闭容器中按
 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。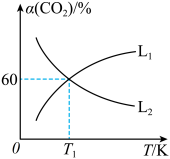
①图中能表示
 随温度变化的曲线是
随温度变化的曲线是 ”或“
”或“ ”),原因为
”),原因为②
 K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为 K时反应
K时反应 的压强平衡常数
的压强平衡常数
 (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
您最近一年使用:0次
今日更新
|
39次组卷
|
3卷引用:2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学
2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题
2 . 为减小或消除CO2对环境的影响,科学家加强了对CO2创新利用的研究。回答下列问题:
(1)将CO2通过光热催化还原为高附加值碳氢燃料,包括以下反应:
反应I.

反应Ⅱ.

①已知反应Ⅲ.
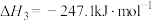 ,则
,则
___________ kJ·mol-1。
②350℃时,将0.5molCO2、1.5molH2通入恒压密闭容器中,在0.1gCo3O4催化下发生反应I和反应Ⅱ,10h后达到平衡,CO2转化率为75%,CO的产量为0.075mol,则CH4的产率为___________ mol·h-1·g-1(产率= ),CH4选择性为
),CH4选择性为___________ (选择性=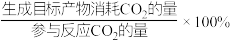 ),反应Ⅱ的
),反应Ⅱ的
___________ 。
(2)在催化剂的作用下,CO2高选择性转化为乙醇的反应原理为 。
。
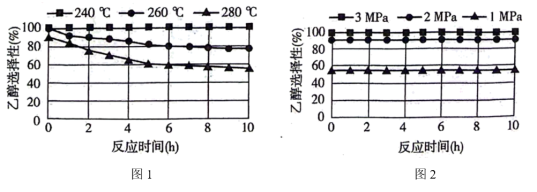
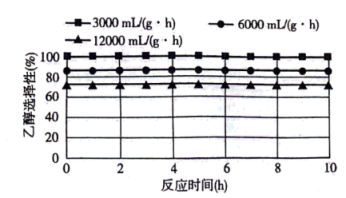
①图1、图2是温度、压强对乙醇选择性的影响,则最佳温度和压强分别为___________ 。___________ 。
①写出在酸性介质中CO2转化为CH4的电极反应式:___________ 。
②理论上生成等物质的量的CH4和HCOOH时消耗的电能之比为___________ 。
(1)将CO2通过光热催化还原为高附加值碳氢燃料,包括以下反应:
反应I.


反应Ⅱ.


①已知反应Ⅲ.

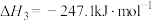 ,则
,则
②350℃时,将0.5molCO2、1.5molH2通入恒压密闭容器中,在0.1gCo3O4催化下发生反应I和反应Ⅱ,10h后达到平衡,CO2转化率为75%,CO的产量为0.075mol,则CH4的产率为
 ),CH4选择性为
),CH4选择性为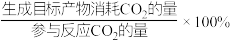 ),反应Ⅱ的
),反应Ⅱ的
(2)在催化剂的作用下,CO2高选择性转化为乙醇的反应原理为
 。
。①图1、图2是温度、压强对乙醇选择性的影响,则最佳温度和压强分别为
①写出在酸性介质中CO2转化为CH4的电极反应式:
②理论上生成等物质的量的CH4和HCOOH时消耗的电能之比为
您最近一年使用:0次
3 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)已知: 、
、 和
和 键的键能分别为
键的键能分别为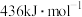 、
、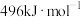 和
和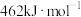 。
。

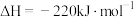

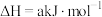
则
___________ 。
(2)已知: 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。___________ (填I或II)时,反应过程中 所能达到的最高浓度更大。
所能达到的最高浓度更大。
②在相同条件下反应达到平衡状态,为提高 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是___________ 。
(3)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.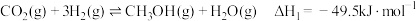
II.
在密闭容器中,压强恒为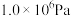 ,
,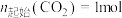 ,
,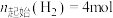 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。 的选择性可表示为
的选择性可表示为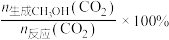 。
。
①反应的最佳温度___________ 。
②反应温度超过 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是___________ 。
③反应温度超过 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是___________ 。
④反应温度在 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时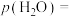
___________  (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数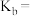
___________ 。
(4)工业废气中含有的 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。___________ 。
②装置b中,x和y为石墨电极,写出电极x的电极反应___________ 。
(1)已知:
 、
、 和
和 键的键能分别为
键的键能分别为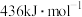 、
、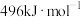 和
和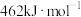 。
。
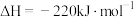

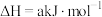
则

(2)已知:
 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。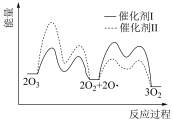
 所能达到的最高浓度更大。
所能达到的最高浓度更大。②在相同条件下反应达到平衡状态,为提高
 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是(3)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
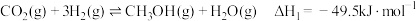
II.

在密闭容器中,压强恒为
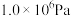 ,
,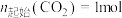 ,
,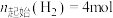 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。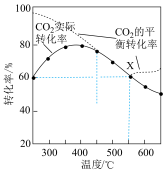
 的选择性可表示为
的选择性可表示为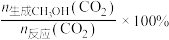 。
。①反应的最佳温度
②反应温度超过
 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是③反应温度超过
 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是④反应温度在
 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时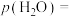
 (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数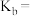
(4)工业废气中含有的
 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。
②装置b中,x和y为石墨电极,写出电极x的电极反应
您最近一年使用:0次
解题方法
4 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和,因此 的综合利用成为研究热点。
的综合利用成为研究热点。
(1)通过捕捉空气中的 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
_______  。
。
(2)利用电喷雾电离等方法可得 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: 与
与 反应的能量变化曲线为
反应的能量变化曲线为_______ (填“c”或“d”),写出 与
与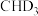 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:_______ 或_______ 。
(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:
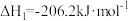
反应Ⅱ:
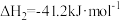
反应皿: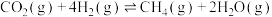
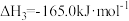
T℃时,向恒容密闭容器中充入一定量的 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率 及
及 和
和 的物质的量
的物质的量 随
随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线是
变化的曲线是_______ (填“a”、“b”、“c”或“d”);
_______ ; 的选择性
的选择性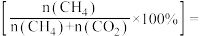
_______ 。
②已知起始充入1mol 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
_______ (用含 的代数式表示)。
的代数式表示)。
 的综合利用成为研究热点。
的综合利用成为研究热点。(1)通过捕捉空气中的
 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
 。
。(2)利用电喷雾电离等方法可得
 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: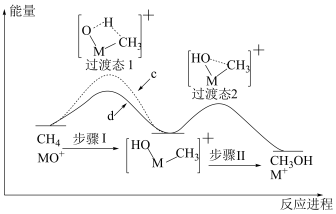
 与
与 反应的能量变化曲线为
反应的能量变化曲线为 与
与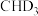 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:

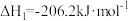
反应Ⅱ:

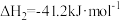
反应皿:
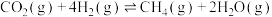
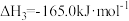
T℃时,向恒容密闭容器中充入一定量的
 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率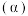 及
及 和
和 的物质的量
的物质的量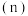 随
随 变化的情况如图所示。
变化的情况如图所示。
 变化的曲线是
变化的曲线是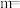
 的选择性
的选择性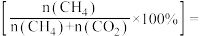
②已知起始充入1mol
 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
5 . CO2资源化利用备受关注,研究CO2资源化综合利用有重要意义。已知:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) H1=+41.2kJ/mol
H1=+41.2kJ/mol
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) H2=-122.5kJ/mol
H2=-122.5kJ/mol
回答下列问题:
(1)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H=
H=___________ kJ/mol。
(2)将4molCO、6molH2置于某密闭容器中,控制适当条件使其发生反应:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),测得CO的某种平衡量值(x)在不同压强下随温度的变化如图1所示:
CH3OCH3(g)+H2O(g),测得CO的某种平衡量值(x)在不同压强下随温度的变化如图1所示:___________ (填“体积分数”或“转化率”),为了提高反应速率的同时能提高H2的转化率,可采取的措施有___________ (填字母)。
a.使用高效催化剂 b.缩小容器的体积
c.升高温度 d.增大H2的浓度
②若p1=6MPa,B点表示反应从开始进行到10min时达到平衡状态,则v(H2)=___________ MPa·min-1,Kp=___________ MPa-4(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若对D点状态的反应同时进行降温、缩小体积的操作,重新达到平衡状态可能是图中A~G点中的___________ 点。
(3)在恒压密闭容器中投入xmolCO2和ymolH2,发生上述反应Ⅰ和Ⅱ。测得CO2的平衡转化率和平衡时CO的选择性(CO的选择性=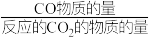 ×100%)随温度的变化曲线如图2所示。
×100%)随温度的变化曲线如图2所示。
①T℃达到平衡时,反应Ⅱ理论上消耗CO2的物质的量为___________ mol。
②合成二甲醚的适宜温度为260℃,其原因是___________ 。
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g)
 H1=+41.2kJ/mol
H1=+41.2kJ/mol反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)
 H2=-122.5kJ/mol
H2=-122.5kJ/mol回答下列问题:
(1)反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H=
H=(2)将4molCO、6molH2置于某密闭容器中,控制适当条件使其发生反应:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g),测得CO的某种平衡量值(x)在不同压强下随温度的变化如图1所示:
CH3OCH3(g)+H2O(g),测得CO的某种平衡量值(x)在不同压强下随温度的变化如图1所示: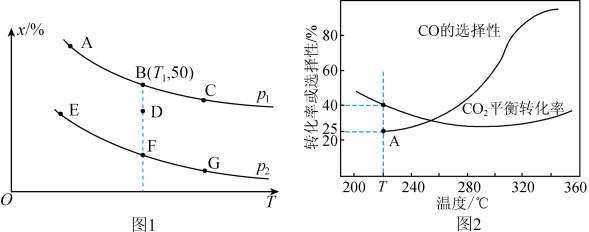
a.使用高效催化剂 b.缩小容器的体积
c.升高温度 d.增大H2的浓度
②若p1=6MPa,B点表示反应从开始进行到10min时达到平衡状态,则v(H2)=
③若对D点状态的反应同时进行降温、缩小体积的操作,重新达到平衡状态可能是图中A~G点中的
(3)在恒压密闭容器中投入xmolCO2和ymolH2,发生上述反应Ⅰ和Ⅱ。测得CO2的平衡转化率和平衡时CO的选择性(CO的选择性=
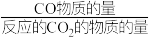 ×100%)随温度的变化曲线如图2所示。
×100%)随温度的变化曲线如图2所示。①T℃达到平衡时,反应Ⅱ理论上消耗CO2的物质的量为
②合成二甲醚的适宜温度为260℃,其原因是
您最近一年使用:0次
名校
6 . 2023年全国政府工作报告指出,推动重点领域节能降碳减污。一种太空生命保障系统利用电解水供氧,生成的氢气与宇航员呼出的二氧化碳在催化剂作用下生成水和甲烷,水可循环使用。
(1)已知 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
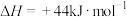 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式_____ 。
(2)一定温度下,在恒容密闭容器中 与
与 反应生成
反应生成 和
和 。
。
①能说明该反应达到平衡状态的是_______ (填字母)。
A. B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定
D.气体密度一定 E. 的体积分数一定
的体积分数一定
②已知容器的容积为5L初始加入0.2mol 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为_______ 。
③温度不变,再加入 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
_______ 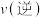 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
(3)工业上在一定条件下利用 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当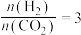 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。
_______ (填“>”或“<”)0。
②图中压强(p)由大到小的顺序是_______ 。
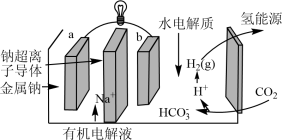
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。_______ 。
(1)已知
 与
与 的燃烧热分别为
的燃烧热分别为 ,
, ,
,
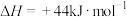 ,写出
,写出 与
与 反应生成
反应生成 和
和 的热化学方程式
的热化学方程式(2)一定温度下,在恒容密闭容器中
 与
与 反应生成
反应生成 和
和 。
。①能说明该反应达到平衡状态的是
A.
 B.容器内压强一定 C.气体平均相对分子,质量一定
B.容器内压强一定 C.气体平均相对分子,质量一定D.气体密度一定 E.
 的体积分数一定
的体积分数一定②已知容器的容积为5L初始加入0.2mol
 和0.6mol
和0.6mol ,反应平衡后测得
,反应平衡后测得 的转化率为50%,则该反应的平衡常数为
的转化率为50%,则该反应的平衡常数为③温度不变,再加入
 、
、 、
、 、
、 各0.2mol,则
各0.2mol,则
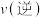 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)(3)工业上在一定条件下利用
 与
与 可直接合成有机中间体二甲醚:
可直接合成有机中间体二甲醚: 。当
。当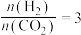 时,实验测得
时,实验测得 的平衡转化率檤温度及压强变化如图所示。
的平衡转化率檤温度及压强变化如图所示。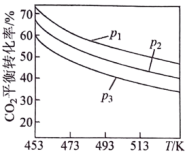

②图中压强(p)由大到小的顺序是
(4)科学家研发出一种新系统,通过“溶解”水中的二氧化碳,以触发电化学反应,有效减少碳的排放,其工作原理如图所示。
您最近一年使用:0次
解题方法
7 . 苯乙烯是一种很重要的有机化学原料,用途十分广泛。在以水蒸气做稀释剂、存在催化剂的条件下,乙苯催化脱氢可生成苯乙烯。可能发生如下两个反应;
主反应: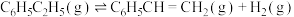
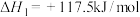 ;
;
副反应: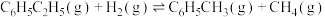
 。
。
回答下列问题:
(1)已知,在 、
、 条件下,
条件下,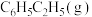 、
、 、
、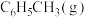 、
、 的燃烧热分别为
的燃烧热分别为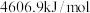 、
、 、
、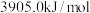 、
、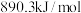 。则
。则
_______  。
。
(2)在某温度、pkPa的条件下,向反应器中充入 气态乙苯发生主反应:
气态乙苯发生主反应: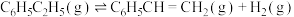 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至_______ 。
(3)在不同的温度条件下,以水烃比 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应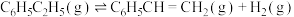 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: 移出率
移出率
 ×100%。
×100%。
①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
_______ (用含 、b、p的代数式表示)。
、b、p的代数式表示)。
②乙苯的平衡转化率增长百分数与 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:
高温下副反应程度极小,试说明当温度高于950℃时,乙苯的平衡转化率随 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:_______ 。
③下列说法正确的是_______ (填选项字母)。
A.生成 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等
B.因为 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应
C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态
(4)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (写一点即可)。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是_______ 。
主反应:
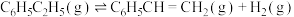
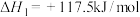 ;
;副反应:
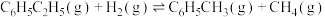
 。
。回答下列问题:
(1)已知,在
 、
、 条件下,
条件下,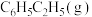 、
、 、
、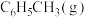 、
、 的燃烧热分别为
的燃烧热分别为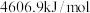 、
、 、
、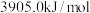 、
、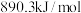 。则
。则
 。
。(2)在某温度、pkPa的条件下,向反应器中充入
 气态乙苯发生主反应:
气态乙苯发生主反应: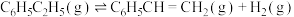 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至(3)在不同的温度条件下,以水烃比
 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应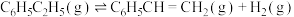 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: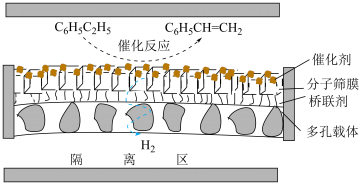
 移出率
移出率
 ×100%。
×100%。①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为
 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
 、b、p的代数式表示)。
、b、p的代数式表示)。②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当
 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态(4)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示: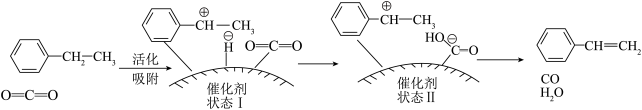
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是
您最近一年使用:0次
解题方法
8 . 甲烷和乙炔(CH≡CH)在有机合成中有着广泛的用途。
(1)已知:①
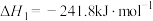
②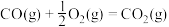

③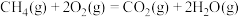
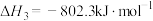
写出甲烷与水蒸气在高温下制备合成气(CO、 )的热化学方程式:
)的热化学方程式:___________ 。
(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为
 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
___________ (用气体平衡分压代替浓度计算)。
② ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入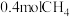 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得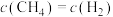 ,则
,则 的转化率为
的转化率为___________ 。若改变温度至 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
___________ (填“>”或“<”) 。
。
(3)一定温度下,向体积为2L的恒容密闭容器中充入 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: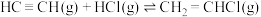
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。
___________ (填“>”“<”或“=”) 。
。
②15min时仅改变了一个外界条件,改变的条件可能是___________ 。
③0~10min内氯乙烯的平均反应速率
___________  。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是___________ 。
(1)已知:①

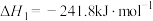
②
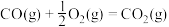

③
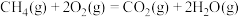
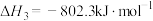
写出甲烷与水蒸气在高温下制备合成气(CO、
 )的热化学方程式:
)的热化学方程式:(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为

 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。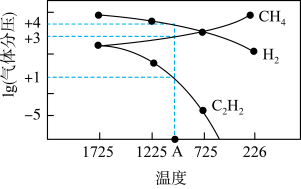

②
 ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入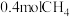 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得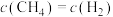 ,则
,则 的转化率为
的转化率为 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
 。
。(3)一定温度下,向体积为2L的恒容密闭容器中充入
 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: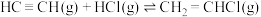
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。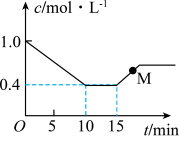

 。
。②15min时仅改变了一个外界条件,改变的条件可能是
③0~10min内氯乙烯的平均反应速率

 。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是
您最近一年使用:0次
解题方法
9 .  作为碳源加氢是能源再生的有效方法,利用
作为碳源加氢是能源再生的有效方法,利用 加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
(1)已知反应Ⅰ:

反应Ⅱ:
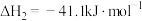
反应Ⅲ:

 的燃烧热
的燃烧热 分别为
分别为 。
。
①
_____  ,反应①的活化能
,反应①的活化能 (正)
(正)_____ (填“大于”“小于”或“等于”) (逆)。
(逆)。
②若 分别表示反应Ⅰ、反应Ⅱ的平衡常数,则
分别表示反应Ⅰ、反应Ⅱ的平衡常数,则 的平衡常数
的平衡常数
_____ (用含 的代数式表示)。
的代数式表示)。
(2)在催化剂作用下,发生上述反应Ⅰ、反应Ⅱ,达到平衡时 的转化率随温度和压强的变化如图,
的转化率随温度和压强的变化如图, 由大到小的顺序为 ;压强一定时,
由大到小的顺序为 ;压强一定时, 的平衡转化率呈现如图变化趋势的原因为
的平衡转化率呈现如图变化趋势的原因为_____ 。 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入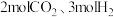 ,发生反应Ⅰ、反应Ⅱ,反应经
,发生反应Ⅰ、反应Ⅱ,反应经 达到平衡,平衡时
达到平衡,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 。
。
①用单位时间内氢气的压强变化表示的反应速率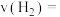
_____ MPa∙min-1。
②反应Ⅱ的平衡常数
_____  。
。
 作为碳源加氢是能源再生的有效方法,利用
作为碳源加氢是能源再生的有效方法,利用 加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
加氢生产甲醇是有前景的可再生路线之一、回答下列问题:(1)已知反应Ⅰ:


反应Ⅱ:

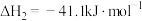
反应Ⅲ:


 的燃烧热
的燃烧热 分别为
分别为 。
。①

 ,反应①的活化能
,反应①的活化能 (正)
(正) (逆)。
(逆)。②若
 分别表示反应Ⅰ、反应Ⅱ的平衡常数,则
分别表示反应Ⅰ、反应Ⅱ的平衡常数,则 的平衡常数
的平衡常数
 的代数式表示)。
的代数式表示)。(2)在催化剂作用下,发生上述反应Ⅰ、反应Ⅱ,达到平衡时
 的转化率随温度和压强的变化如图,
的转化率随温度和压强的变化如图,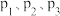 由大到小的顺序为 ;压强一定时,
由大到小的顺序为 ;压强一定时, 的平衡转化率呈现如图变化趋势的原因为
的平衡转化率呈现如图变化趋势的原因为
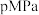 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入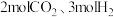 ,发生反应Ⅰ、反应Ⅱ,反应经
,发生反应Ⅰ、反应Ⅱ,反应经 达到平衡,平衡时
达到平衡,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 。
。①用单位时间内氢气的压强变化表示的反应速率
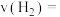
②反应Ⅱ的平衡常数

 。
。
您最近一年使用:0次
10 . 碳达峰、碳中和是现在需要继续完成的环保任务, 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
反应I: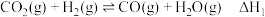
反应Ⅱ:
(1)①相关键能如下表,则
_______ ,该反应的活化能 (正)
(正)_______  (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。
②已知 的正反应速率
的正反应速率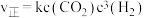 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
则此温度下,表中
______ 。
(2)据文献报道, 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是_______ 。 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系:__________ ;解释压强一定时, 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:_________________ 。 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入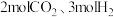 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
_______  ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压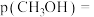
_____  (用含
(用含 的式子表示)。
的式子表示)。
 的综合利用成为热点研究对象,
的综合利用成为热点研究对象, 作为碳源加氢是再生能源的有效方法,
作为碳源加氢是再生能源的有效方法, 加氢可以合成甲醇,
加氢可以合成甲醇, 提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过
提出“甲醇经济”概念,认为甲醇会在不久的将来扮演不可或缺的角色,通过 加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:
加氢生产甲醇是有希望的可再生路线之一,该过程主要发生如下反应:反应I:
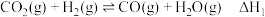
反应Ⅱ:

(1)①相关键能如下表,则

 (正)
(正) (逆)(填“大于”“小于”或“等于”)。
(逆)(填“大于”“小于”或“等于”)。化学键 |
|
|
|
|
键能 | 436 | 1071 | 464 | 803 |
 的正反应速率
的正反应速率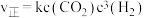 (k为正反应的速率常数),某温度时测得数据如下:
(k为正反应的速率常数),某温度时测得数据如下:
|
|
| |
1 | 0.02 | 0.01 |
|
2 | 0.02 | 0.02 | a |

(2)据文献报道,
 基纳米材料作为高性能催化剂可将
基纳米材料作为高性能催化剂可将 电还原为高能量密度的
电还原为高能量密度的 ,不同催化剂对生成
,不同催化剂对生成 的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是
的法拉第效率与电极电势的变化如图所示(已知法拉第效率是指实际生成物和理论生成物的百分比),为了保证生成甲醇的法拉第效率,最合适的电势及最佳催化剂是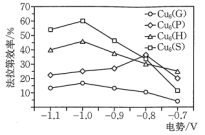
 的转化率随温度和压强的变化如图,判断
的转化率随温度和压强的变化如图,判断 的大小关系:
的大小关系: 的平衡转化率呈现如图变化的原因:
的平衡转化率呈现如图变化的原因:
 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入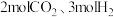 发生反应I、Ⅱ,平衡时
发生反应I、Ⅱ,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 ,则反应Ⅱ的平衡常数
,则反应Ⅱ的平衡常数
 ,体系内甲醇的平衡分压
,体系内甲醇的平衡分压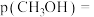
 (用含
(用含 的式子表示)。
的式子表示)。
您最近一年使用:0次