1 .  的资源化途径有多种,其中包括甲烷化、碳酸二甲酯化等。回答下列问题:
的资源化途径有多种,其中包括甲烷化、碳酸二甲酯化等。回答下列问题:
(1) 甲烷化:利用
甲烷化:利用 与
与 合成
合成 ,主要涉及以下反应:
,主要涉及以下反应:
ⅰ.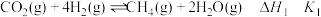 ;
;
ⅱ.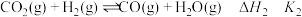 ;
;
ⅲ.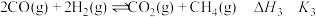 。
。
①上述反应的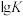 (
( 为平衡常数)随温度
为平衡常数)随温度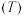 的变化如图1所示,其中属于吸热反应的有
的变化如图1所示,其中属于吸热反应的有_______ (填序号),
_______ (用 、
、 表示)。
表示)。 、
、 ,仅发生反应ⅰ。下列说法正确的是
,仅发生反应ⅰ。下列说法正确的是_______ (填字母)。
A升高温度,反应速率加快,活化能降低
B.使用高效的催化剂能提高单位时间内 的产率
的产率
C.当混合气体的压强保持不变时,反应达到平衡状态
D.反应达到平衡后,其他条件不变,向该容器通入Ar,平衡正向移动
(2)向恒压(pMPa)、密闭容器中通入1mol 和4mol
和4mol ,在催化剂的作用下仅发生反应ⅰ、ⅱ,平衡时
,在催化剂的作用下仅发生反应ⅰ、ⅱ,平衡时 、CO、
、CO、 的物质的量随温度的变化如图2所示。
的物质的量随温度的变化如图2所示。_______ (填化学式);当温度高于 ℃,B物质的量随温度升高而减少的主要原因是
℃,B物质的量随温度升高而减少的主要原因是_______ 。
②在 ℃时,平衡体系中
℃时,平衡体系中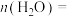
_______ mol,反应ⅱ的压强平衡常数
_______ (保留分数形式,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)碳酸二甲酯化:由 催化
催化 合成碳酸二甲酯(DMC)的反应过程如图3所示。
合成碳酸二甲酯(DMC)的反应过程如图3所示。_______ (填“a”“b”或“c”),合成DMC的总反应的化学方程式为_______ (标注同位素原子)。
 的资源化途径有多种,其中包括甲烷化、碳酸二甲酯化等。回答下列问题:
的资源化途径有多种,其中包括甲烷化、碳酸二甲酯化等。回答下列问题:(1)
 甲烷化:利用
甲烷化:利用 与
与 合成
合成 ,主要涉及以下反应:
,主要涉及以下反应:ⅰ.
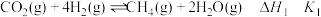 ;
;ⅱ.
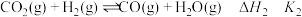 ;
;ⅲ.
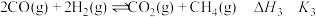 。
。①上述反应的
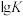 (
( 为平衡常数)随温度
为平衡常数)随温度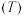 的变化如图1所示,其中属于吸热反应的有
的变化如图1所示,其中属于吸热反应的有
 、
、 表示)。
表示)。
 、
、 ,仅发生反应ⅰ。下列说法正确的是
,仅发生反应ⅰ。下列说法正确的是A升高温度,反应速率加快,活化能降低
B.使用高效的催化剂能提高单位时间内
 的产率
的产率C.当混合气体的压强保持不变时,反应达到平衡状态
D.反应达到平衡后,其他条件不变,向该容器通入Ar,平衡正向移动
(2)向恒压(pMPa)、密闭容器中通入1mol
 和4mol
和4mol ,在催化剂的作用下仅发生反应ⅰ、ⅱ,平衡时
,在催化剂的作用下仅发生反应ⅰ、ⅱ,平衡时 、CO、
、CO、 的物质的量随温度的变化如图2所示。
的物质的量随温度的变化如图2所示。
 ℃,B物质的量随温度升高而减少的主要原因是
℃,B物质的量随温度升高而减少的主要原因是②在
 ℃时,平衡体系中
℃时,平衡体系中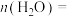

(3)碳酸二甲酯化:由
 催化
催化 合成碳酸二甲酯(DMC)的反应过程如图3所示。
合成碳酸二甲酯(DMC)的反应过程如图3所示。
您最近一年使用:0次
解题方法
2 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和,因此 的综合利用成为研究热点。
的综合利用成为研究热点。
(1)通过捕捉空气中的 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
_______  。
。
(2)利用电喷雾电离等方法可得 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: 与
与 反应的能量变化曲线为
反应的能量变化曲线为_______ (填“c”或“d”),写出 与
与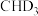 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:_______ 或_______ 。
(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:
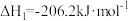
反应Ⅱ:
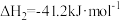
反应皿: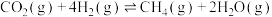
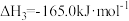
T℃时,向恒容密闭容器中充入一定量的 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率 及
及 和
和 的物质的量
的物质的量 随
随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线是
变化的曲线是_______ (填“a”、“b”、“c”或“d”);
_______ ; 的选择性
的选择性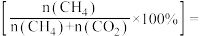
_______ 。
②已知起始充入1mol 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
_______ (用含 的代数式表示)。
的代数式表示)。
 的综合利用成为研究热点。
的综合利用成为研究热点。(1)通过捕捉空气中的
 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
 。
。(2)利用电喷雾电离等方法可得
 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: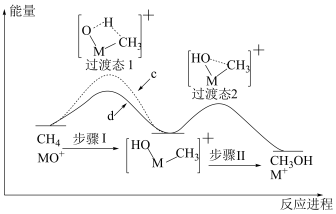
 与
与 反应的能量变化曲线为
反应的能量变化曲线为 与
与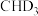 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:

反应Ⅱ:

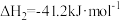
反应皿:
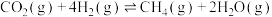
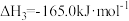
T℃时,向恒容密闭容器中充入一定量的
 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率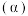 及
及 和
和 的物质的量
的物质的量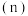 随
随 变化的情况如图所示。
变化的情况如图所示。
 变化的曲线是
变化的曲线是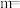
 的选择性
的选择性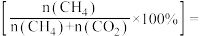
②已知起始充入1mol
 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-29更新
|
136次组卷
|
2卷引用:2024届陕西省铜川市高三下学期第三次模拟考试理科综合试题-高中化学
名校
解题方法
3 . 一定条件下,CO与水蒸气反应生成CO2和H2的热化学方程式为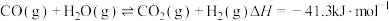 。回答下列问题:
。回答下列问题:
(1)已知1 mol C完全转化成水煤气(CO、H2混合物)时吸收热量131.5 kJ,则1mol C与CO2反应生成CO的焓变是_______
(2)上述反应达到平衡的标志是_______ (填字母)。
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内CO、H2O的浓度之比为1∶1
D.单位时间消耗0.1 molCO同时生成0.1 mol H2O
(3)研究表明:上述反应平衡常数随温度的变化如下表所示:
若反应为500℃,起始时CO和H2O的浓度均为0.02 mol/L,则达到平衡时,CO的平衡转化率为_______
(4)在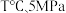 条件下,将0.1 molCO与0.12 mol H2O(g)混合气体充入1 L密闭容器发生反应,反应过程中CO2的物质的量浓度随时间的变化如图所示:
条件下,将0.1 molCO与0.12 mol H2O(g)混合气体充入1 L密闭容器发生反应,反应过程中CO2的物质的量浓度随时间的变化如图所示:
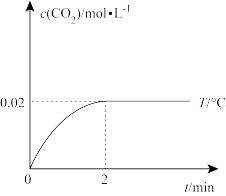
①在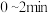 内,以CO表示的平均反应速率为
内,以CO表示的平均反应速率为_______ 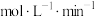 。
。
②T℃时该反应的平衡常数Kp=_______ (压强代替浓度,分压=总压×物质的分数)。
③平衡后,若向容器中再充入0.2 molCO和0.02 mol H2O(g),则再次平衡后容器内的压强与充入CO和H2O(g)前的压强比为_______
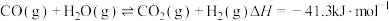 。回答下列问题:
。回答下列问题:(1)已知1 mol C完全转化成水煤气(CO、H2混合物)时吸收热量131.5 kJ,则1mol C与CO2反应生成CO的焓变是
(2)上述反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内CO、H2O的浓度之比为1∶1
D.单位时间消耗0.1 molCO同时生成0.1 mol H2O
(3)研究表明:上述反应平衡常数随温度的变化如下表所示:
温度/ | 400 | 500 | 800 |
| 平衡常数K | 15 | 9 | 5 |
(4)在
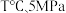 条件下,将0.1 molCO与0.12 mol H2O(g)混合气体充入1 L密闭容器发生反应,反应过程中CO2的物质的量浓度随时间的变化如图所示:
条件下,将0.1 molCO与0.12 mol H2O(g)混合气体充入1 L密闭容器发生反应,反应过程中CO2的物质的量浓度随时间的变化如图所示:
①在
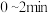 内,以CO表示的平均反应速率为
内,以CO表示的平均反应速率为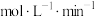 。
。②T℃时该反应的平衡常数Kp=
③平衡后,若向容器中再充入0.2 molCO和0.02 mol H2O(g),则再次平衡后容器内的压强与充入CO和H2O(g)前的压强比为
您最近一年使用:0次
2022-04-04更新
|
400次组卷
|
2卷引用:陕西省铜川市第一中学2021-2022学年高二上学期期末考试化学试题



