解题方法
1 . CH3OH是一种绿色能源,也是一种化工原料。回答下列问题:
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是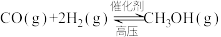
 。
。
(1)已知:①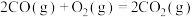
 kJ⋅mol
kJ⋅mol
②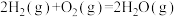
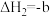 kJ⋅mol
kJ⋅mol
③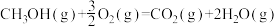
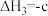 kJ⋅mol
kJ⋅mol
上述反应的
___________ kJ⋅mol (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。
(2)在恒温恒容密闭容器中充入1 mol 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。___________ (填“高于”或“低于”)乙,判断依据是___________ 。
②
___________ (填“>”“<”或“=”)0,判断依据是___________ 。
③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为___________ mol⋅L ⋅min
⋅min 。
。
Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为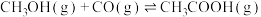 、
、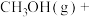
 。
。
(4)以CH3OH和CO为原料,从原子利用率分析,合成___________ (填“CH3COOH”或“CH3COOCH3”)是最理想的绿色化学工艺。
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成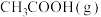 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,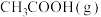 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性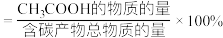 )。该温度下合成
)。该温度下合成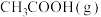 反应的平衡常数
反应的平衡常数
___________  (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
Ⅰ.合成甲醇。
工业上常用CO和H2制备CH3OH,反应原理是
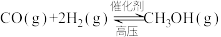
 。
。(1)已知:①
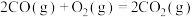
 kJ⋅mol
kJ⋅mol
②
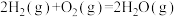
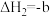 kJ⋅mol
kJ⋅mol
③
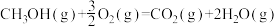
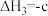 kJ⋅mol
kJ⋅mol
上述反应的

 (用含a、b、c的代数式表示)。
(用含a、b、c的代数式表示)。(2)在恒温恒容密闭容器中充入1 mol
 和1 mol
和1 mol  合成
合成 。下列情况表明该反应一定达到平衡状态的是___________(填字母)。
。下列情况表明该反应一定达到平衡状态的是___________(填字母)。| A.气体压强不随时间变化 | B.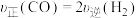 |
| C.气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(3)向体积相同的甲、乙恒容密闭容器中均充入1 mol
 和3 mol
和3 mol  同时发生反应合成
同时发生反应合成 ,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。
,相对甲,乙仅改变温度,测得甲醇的物质的量与时间的关系如图所示。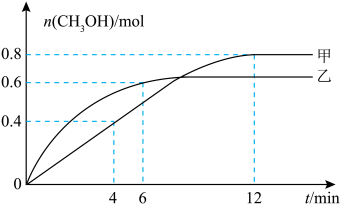
②

③若容器体积为1 L,甲容器中0~4 min内用H2表示的平均反应速率为
 ⋅min
⋅min 。
。Ⅱ.可用于合成有机物。
近日,中国科学院大连化学物理研究所丁云杰团队利用Rh单核配合物催化剂以和CO为原料合成了CH3COOH,相关反应为
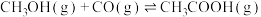 、
、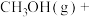
 。
。(4)以CH3OH和CO为原料,从原子利用率分析,合成
(5)一定温度下,总压强保持1.5a kPa,向反应器中充入1 mol
 和1 mol
和1 mol  ,在一定条件下合成
,在一定条件下合成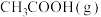 和
和 。达到平衡时,
。达到平衡时, 的转化率为60%,
的转化率为60%,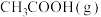 的选择性为80%,(
的选择性为80%,( 的选择性
的选择性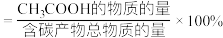 )。该温度下合成
)。该温度下合成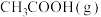 反应的平衡常数
反应的平衡常数
 (用含a的代数式表示,
(用含a的代数式表示, 为用分压表示的平衡常数,分压=总压×物质的量分数)。
为用分压表示的平衡常数,分压=总压×物质的量分数)。
您最近一年使用:0次
2 .  的资源化不仅能减少
的资源化不仅能减少 排放,还能有效利用碳资源。
排放,还能有效利用碳资源。
(1) 制取低碳醇的反应如下:
制取低碳醇的反应如下:
反应Ⅰ:
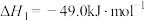
反应Ⅱ:

则 与
与 合成
合成 的热化学方程式为
的热化学方程式为___________ ;在密闭容器中,按 充入
充入 和
和 ,平衡时
,平衡时 、含碳物质的物质的量分数随温度变化的曲线如图所示,图中表示
、含碳物质的物质的量分数随温度变化的曲线如图所示,图中表示 组分的是曲线
组分的是曲线___________ (填序号)。

(2)250℃时,向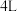 恒容密闭容器中通入
恒容密闭容器中通入 、
、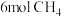 ,发生如下反应:
,发生如下反应: 。平衡时,各组分体积分数如下表所示。
。平衡时,各组分体积分数如下表所示。
该条件下, 的平衡转化率为
的平衡转化率为___________ ;向平衡体系中再通入 、
、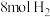 ,平衡
,平衡___________ (填“正向移动”、“逆向移动”或“不移动”)。
(3)用 溶液吸收
溶液吸收 可得
可得 溶液。室温下,
溶液。室温下,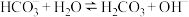 的平衡常数K=
的平衡常数K=___________ [已知: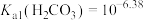 ]。在密闭容器中,向含有催化剂的
]。在密闭容器中,向含有催化剂的 溶液中通入
溶液中通入 制备
制备 ,测得
,测得 的转化率随温度的变化如图所示。在40℃至80℃过程中,转化率迅速上升的原因是
的转化率随温度的变化如图所示。在40℃至80℃过程中,转化率迅速上升的原因是___________ 。

 的资源化不仅能减少
的资源化不仅能减少 排放,还能有效利用碳资源。
排放,还能有效利用碳资源。(1)
 制取低碳醇的反应如下:
制取低碳醇的反应如下:反应Ⅰ:

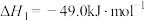
反应Ⅱ:


则
 与
与 合成
合成 的热化学方程式为
的热化学方程式为 充入
充入 和
和 ,平衡时
,平衡时 、含碳物质的物质的量分数随温度变化的曲线如图所示,图中表示
、含碳物质的物质的量分数随温度变化的曲线如图所示,图中表示 组分的是曲线
组分的是曲线
(2)250℃时,向
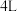 恒容密闭容器中通入
恒容密闭容器中通入 、
、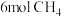 ,发生如下反应:
,发生如下反应: 。平衡时,各组分体积分数如下表所示。
。平衡时,各组分体积分数如下表所示。| 物质 |  |  | CO |  |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 的平衡转化率为
的平衡转化率为 、
、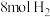 ,平衡
,平衡(3)用
 溶液吸收
溶液吸收 可得
可得 溶液。室温下,
溶液。室温下,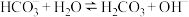 的平衡常数K=
的平衡常数K=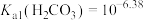 ]。在密闭容器中,向含有催化剂的
]。在密闭容器中,向含有催化剂的 溶液中通入
溶液中通入 制备
制备 ,测得
,测得 的转化率随温度的变化如图所示。在40℃至80℃过程中,转化率迅速上升的原因是
的转化率随温度的变化如图所示。在40℃至80℃过程中,转化率迅速上升的原因是
您最近一年使用:0次
3 . 硫及其化合物在日常生活、工业生产中都非常普遍。
(1)变废为宝是治理污染的常用手段。以 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
(i)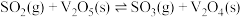
(ii)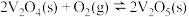
能量变化如图所示。
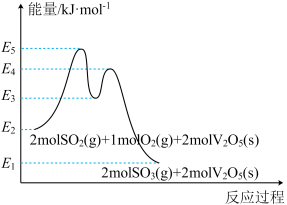
总反应 的
的
_____  (用
(用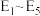 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤____ (填i或ii),其活化能为______  (用
(用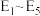 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。
(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为: ,
, 。
。
① 时,
时, 溶液的
溶液的
_____ 7(填“>”“<”或“=”)。
② 的稀硫酸中,
的稀硫酸中,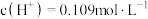 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
_______ (只列式,不计算)。
(3)液态水中,水存在自偶电离: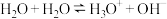 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。
①液态的醋酸(用 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为____ 。
②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是____ 。若保持温度不变,关于该所得溶液,下列说法正确的是____ 。
A.加入少量冰醋酸,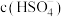 与
与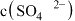 均减小
均减小
B.加入少量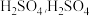 的电离程度增大
的电离程度增大
C.加入少量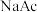 固体,
固体,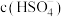 与
与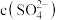 的比值减小
的比值减小
D.加入少量 固体,
固体,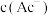 减小
减小
(1)变废为宝是治理污染的常用手段。以
 为催化剂,将
为催化剂,将 氧化为
氧化为 ,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:
,再进一步转化为硫酸,是工业上制取硫酸的常用方法。该过程可分为如下步骤:(i)
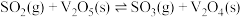
(ii)
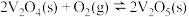
能量变化如图所示。

总反应
 的
的
 (用
(用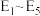 中的合理数据组成的代数式表示)。决定
中的合理数据组成的代数式表示)。决定 催化氧化总反应速率的是步骤
催化氧化总反应速率的是步骤 (用
(用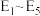 中的合理数据组成的代数式表示)。
中的合理数据组成的代数式表示)。(2)在水中,硫酸是一种强酸,但实际上只有第一步电离是完全的,第二步电离并不完全,电离方程式可表示为:
 ,
, 。
。①
 时,
时, 溶液的
溶液的
②
 的稀硫酸中,
的稀硫酸中,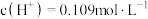 ,则硫酸第二步电离的电离常数
,则硫酸第二步电离的电离常数
(3)液态水中,水存在自偶电离:
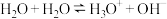 。平常书写的
。平常书写的 ,实际上是纯水或水溶液中
,实际上是纯水或水溶液中 的缩写。如
的缩写。如 在水中电离,完整写法是
在水中电离,完整写法是 。
。①液态的醋酸(用
 表示)中,同样存在
表示)中,同样存在 的自偶电离,其方程式可表示为
的自偶电离,其方程式可表示为②用醋酸作溶剂时,硫酸是一种二元弱酸。将少量
 溶于冰醋酸中,第一步电离的完整写法是
溶于冰醋酸中,第一步电离的完整写法是A.加入少量冰醋酸,
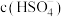 与
与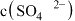 均减小
均减小B.加入少量
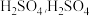 的电离程度增大
的电离程度增大C.加入少量
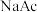 固体,
固体,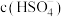 与
与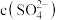 的比值减小
的比值减小D.加入少量
 固体,
固体,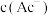 减小
减小
您最近一年使用:0次
2024-02-14更新
|
72次组卷
|
2卷引用:海南省海南中学2023- 2024学年高三上学期第4次月考化学试题
名校
解题方法
4 . 在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:O2(g)+2H2(g) 2H2O(l) ΔH1=-571.6 kJ /mol
2H2O(l) ΔH1=-571.6 kJ /mol
S(s)+O2(g) SO2(g) ΔH2=-296.9 kJ /mol
SO2(g) ΔH2=-296.9 kJ /mol
则H2(g)还原烟气中的SO2(g)的热化学方程式为___________ 。
(2)在容积为10 L的容器中充入1 mol SO2(g)与2 mol H2(g)的混合气体,发生反应SO2(g)+2H2(g) S(s)+2H2O(g) ΔH<0。
S(s)+2H2O(g) ΔH<0。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=___________ mol·L-1·s-1,平衡时,c(SO2)=___________ mol·L-1;若平衡后升高温度,SO2的转化率将___________ (填“增大”、“减小”或“不变”)。
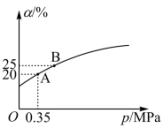
② 恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数Kp=___________ MPa-1 (用平衡分压代替平衡浓度计算,气体分压=气体总压强×气体的物质的量分数);平衡状态由A变到B,平衡常数K(A)___________ (填“>”、“<”或“=”) K(B)。
③ 若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是___________ (填标号)。
A.压强不再变化
B.气体的密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2O(g)的生成速率之比为1∶2
(1)已知:O2(g)+2H2(g)
 2H2O(l) ΔH1=-571.6 kJ /mol
2H2O(l) ΔH1=-571.6 kJ /molS(s)+O2(g)
 SO2(g) ΔH2=-296.9 kJ /mol
SO2(g) ΔH2=-296.9 kJ /mol则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10 L的容器中充入1 mol SO2(g)与2 mol H2(g)的混合气体,发生反应SO2(g)+2H2(g)
 S(s)+2H2O(g) ΔH<0。
S(s)+2H2O(g) ΔH<0。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
② 恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数Kp=

③ 若在恒温恒容密闭容器中发生上述反应,下列可作为该反应达到平衡状态的标志是
A.压强不再变化
B.气体的密度不再变化
C.气体的平均相对分子质量不再变化
D.SO2的消耗速率与H2O(g)的生成速率之比为1∶2
您最近一年使用:0次
5 . 硫化氢(H2S)为易燃危化品,与空气混合能形成爆炸性混合物,遇明火、高热能引起燃烧爆炸,并且硫化氢有剧毒。石油与天然气开采、石油化工、煤化工等行业废气中普遍含有硫化氢,需要回收处理并加以利用。根据所学知识回答下列问题:
(1)已知:Ⅰ.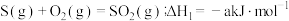 (a>0)
(a>0)
Ⅱ.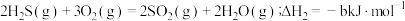 (b>0)
(b>0)
Ⅲ.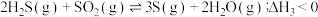
若反应Ⅲ中正反应的活化能为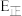 ,逆反应的活化能为
,逆反应的活化能为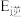 ,则
,则 =
=___________ (填含a、b的代数式) ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是___________ (填标号)。
A.体系压强不再变化
B.断裂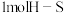 键的同时断裂
键的同时断裂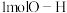 键
键
C.混合气体的密度不再变化
D.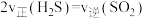
(2)利用工业废气 生产
生产 的反应为
的反应为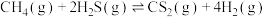 。向某容器中充入
。向某容器中充入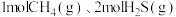 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
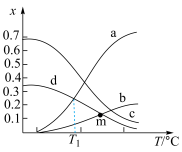
①图中表示 的曲线是
的曲线是___________ (填标号,下同),表示 的曲线是
的曲线是___________ 。
②T1℃时,该反应的
___________ (列出表达式即可,用平衡分压代替平衡浓度,分压 总压×物质的量分数)。
总压×物质的量分数)。
(1)已知:Ⅰ.
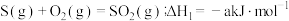 (a>0)
(a>0)Ⅱ.
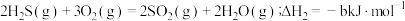 (b>0)
(b>0)Ⅲ.
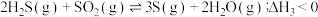
若反应Ⅲ中正反应的活化能为
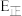 ,逆反应的活化能为
,逆反应的活化能为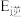 ,则
,则 =
= ;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是
;在某恒温恒容体系中仅发生反应Ⅲ,下列叙述能说明反应Ⅲ达到平衡状态的是A.体系压强不再变化
B.断裂
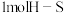 键的同时断裂
键的同时断裂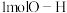 键
键C.混合气体的密度不再变化
D.
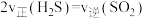
(2)利用工业废气
 生产
生产 的反应为
的反应为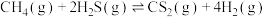 。向某容器中充入
。向某容器中充入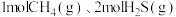 ,体系起始总压强为
,体系起始总压强为 ,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
,保持体系总压强不变,反应达到平衡时,四种组分的物质的量分数(x)随温度(T/℃)的变化如图。
①图中表示
 的曲线是
的曲线是 的曲线是
的曲线是②T1℃时,该反应的

 总压×物质的量分数)。
总压×物质的量分数)。
您最近一年使用:0次
6 .  是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
(1)已知:①

②
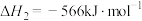
③
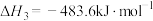
则 的
的
___________  。
。
(2)恒温恒容条件下,向密闭容器中充入1
 和2
和2
 合成
合成 ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。
(3)一定温度下,保持总压强为2.0 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性 。该温度下,
。该温度下, 的平衡常数
的平衡常数
___________  。
。
(4)常温下,向 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
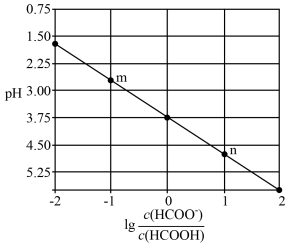
则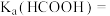
___________ ,n点溶液中离子浓度由大到小的排序为___________ 。
 是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:
是最简单的有机羧酸,常作抗菌剂和化工原料。回答下列问题:(1)已知:①


②

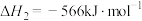
③

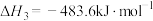
则
 的
的
 。
。(2)恒温恒容条件下,向密闭容器中充入1

 和2
和2
 合成
合成 ,下列叙述正确的是___________(填字母)。
,下列叙述正确的是___________(填字母)。| A.气体压强不随时间变化时达到平衡状态 |
B.平衡时 的最大体积分数为50% 的最大体积分数为50% |
C.平衡后及时移走 ,平衡常数增大 ,平衡常数增大 |
D.平衡后再充入 , , 的平衡转化率增大 的平衡转化率增大 |
(3)一定温度下,保持总压强为2.0
 ,向密闭容器中充入1
,向密闭容器中充入1
 和1.6
和1.6
 ,发生反应:
,发生反应: 、
、 。反应达到平衡时
。反应达到平衡时 的转化率为50%,
的转化率为50%, 的选择性为80%(已知:甲酸的选择性
的选择性为80%(已知:甲酸的选择性 。该温度下,
。该温度下, 的平衡常数
的平衡常数
 。
。(4)常温下,向
 溶液中滴加
溶液中滴加 溶液。溶液的
溶液。溶液的 与
与 的关系如图所示。
的关系如图所示。
则
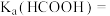
您最近一年使用:0次
2023-12-16更新
|
217次组卷
|
2卷引用:海南省2023-2024学年高三上学期高考全真模拟卷(四)化学试题
名校
解题方法
7 . 过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成。医疗消毒等领域。回答下列问题:
(1)已知: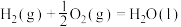
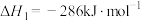
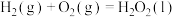
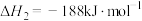
过氧化氢分解反应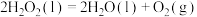 的
的
___________  。
。
(2)早期制备方法: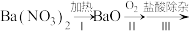 滤液
滤液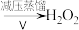
①I为分解反应,产物除BaO、 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是___________ 。
②Ⅱ为可逆反应,写出一条促进该反应正向进行的措施是___________ 。
③Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
④减压能够降低蒸馏温度,从 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:________ 。
(1)已知:
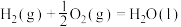
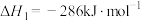
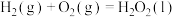
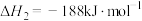
过氧化氢分解反应
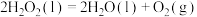 的
的
 。
。(2)早期制备方法:
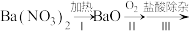 滤液
滤液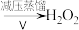
①I为分解反应,产物除BaO、
 外,还有一种红棕色气体。该反应的化学方程式是
外,还有一种红棕色气体。该反应的化学方程式是②Ⅱ为可逆反应,写出一条促进该反应正向进行的措施是
③Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是④减压能够降低蒸馏温度,从
 的化学性质角度说明V中采用减压蒸馏的原因:
的化学性质角度说明V中采用减压蒸馏的原因:
您最近一年使用:0次
名校
8 . 氢气是清洁能源,工业上用天然气为原料制备氢气的有关反应如下:
I.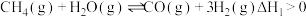
II.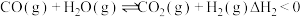
回答下列问题:
(1)在恒温恒容密闭容器中充入 和
和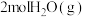 ,发生上述反应。下列叙述正确的是___________(填字母)。
,发生上述反应。下列叙述正确的是___________(填字母)。
(2)写出 和
和 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式:___________ ( 用
用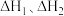 的关系式表示)。
的关系式表示)。
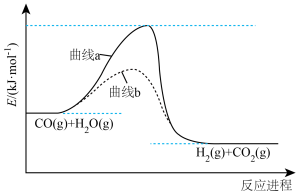
(3) 和水蒸气反应的能量变化如图所示。
和水蒸气反应的能量变化如图所示。
已知:i.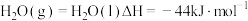 。
。
ii.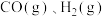 的燃烧热
的燃烧热 分别为
分别为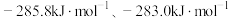 。
。
①启动该反应需要加热,其主要作用是___________ (填字母)。
A.降低活化能 B.改变反应历程
C.增大反应物能量 D.增大产物能量
②图中代表加入催化剂的曲线是___________ (填“a”或“b”)。
③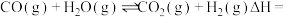
___________  。
。
I.
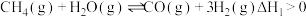
II.
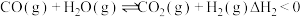
回答下列问题:
(1)在恒温恒容密闭容器中充入
 和
和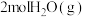 ,发生上述反应。下列叙述正确的是___________(填字母)。
,发生上述反应。下列叙述正确的是___________(填字母)。| A.平衡后,增大压强,反应Ⅰ的平衡常数减小 |
| B.平衡后,升高温度,两个反应都向左移动 |
C.平衡后,充入惰性气体, 的平衡转化率增大 的平衡转化率增大 |
D.其他条件不变,增大 浓度,两个反应的正反应速率均增大 浓度,两个反应的正反应速率均增大 |
(2)写出
 和
和 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式: 用
用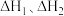 的关系式表示)。
的关系式表示)。(3)
 和水蒸气反应的能量变化如图所示。
和水蒸气反应的能量变化如图所示。
已知:i.
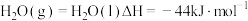 。
。ii.
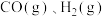 的燃烧热
的燃烧热 分别为
分别为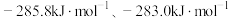 。
。①启动该反应需要加热,其主要作用是
A.降低活化能 B.改变反应历程
C.增大反应物能量 D.增大产物能量
②图中代表加入催化剂的曲线是
③
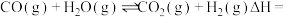
 。
。
您最近一年使用:0次
2023-12-01更新
|
28次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
解题方法
9 . 对主要成分为H2S的工业废气进行回收利用具有重要意义,其反应原理之一为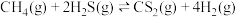 。
。
(1)已知CH4的燃烧热 为
为 ,则表示CH4燃烧热的热化学方程式为
,则表示CH4燃烧热的热化学方程式为___________ 。
(2)已知:反应i.
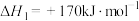
反应ii.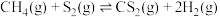
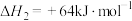
若反应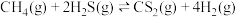 看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:__________ 。

(3)在 和
和 下(
下(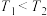 ),向1L恒容密闭容器中充入
),向1L恒容密闭容器中充入
 和
和
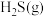 ,仅发生反应
,仅发生反应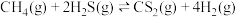 ,测得
,测得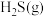 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。

已知:曲线M对应温度下该反应的化学平衡常数为0.05。
①a点和b点对应的容器中,
___________  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是___________ 。
②曲线N对应温度下该反应的化学平衡常数K为___________ 。
③已知:该反应的速率方程为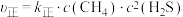 ,
, ,
, 、
、 分别为正、逆反应速率常数,只与温度有关,a点时的
分别为正、逆反应速率常数,只与温度有关,a点时的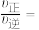
___________ 。
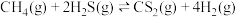 。
。(1)已知CH4的燃烧热
 为
为 ,则表示CH4燃烧热的热化学方程式为
,则表示CH4燃烧热的热化学方程式为(2)已知:反应i.

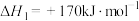
反应ii.
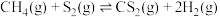
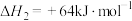
若反应
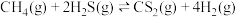 看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
看成由反应i和反应ii两步进行,且反应i的活化能小于反应ii的活化能。请在图中画出反应过程中的能量变化示意图:
(3)在
 和
和 下(
下(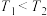 ),向1L恒容密闭容器中充入
),向1L恒容密闭容器中充入
 和
和
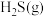 ,仅发生反应
,仅发生反应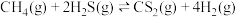 ,测得
,测得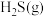 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
已知:曲线M对应温度下该反应的化学平衡常数为0.05。
①a点和b点对应的容器中,

 (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是②曲线N对应温度下该反应的化学平衡常数K为
③已知:该反应的速率方程为
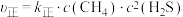 ,
, ,
, 、
、 分别为正、逆反应速率常数,只与温度有关,a点时的
分别为正、逆反应速率常数,只与温度有关,a点时的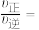
您最近一年使用:0次
解题方法
10 . 我国酸性气藏储量丰富,实现 的高效转移,对于油气资源开采、动植物生存以及生态系统都具有重要意义。
的高效转移,对于油气资源开采、动植物生存以及生态系统都具有重要意义。
(1)目前使用克劳斯工艺处理 。
。
高温反应炉: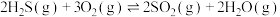
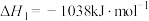
催化转化器: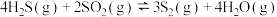

①总反应式 的
的
__________  。
。
②催化转化器中,提高硫回收率的措施可以是__________ 。(任写一条)
③催化转化器内温度一般控制在170~350℃,过低不利于回收硫,其原因是__________ 。
(2)真空 —克劳斯法联合脱硫。用过量
—克劳斯法联合脱硫。用过量 溶液吸收少量
溶液吸收少量 ,其离子方程式为
,其离子方程式为__________ ,该反应的平衡常数的值约为__________ 。(已知 的
的 ,
, ;
; 的
的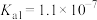 ,
,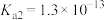 )
)
(3)最新先进方法,使用金属硫化物作光催化分解 制氢的催化剂。但过程伴随复杂的氧化进程,生成多种氧化产物。
制氢的催化剂。但过程伴随复杂的氧化进程,生成多种氧化产物。
①在相同条件下,使用不同催化剂测得的数据制图如下。其中催化效率较好的是__________ 。
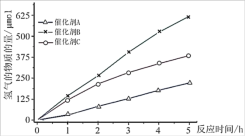
②根据题意,相比克劳斯工艺,光催化分解 的优点是
的优点是__________ 。
 的高效转移,对于油气资源开采、动植物生存以及生态系统都具有重要意义。
的高效转移,对于油气资源开采、动植物生存以及生态系统都具有重要意义。(1)目前使用克劳斯工艺处理
 。
。高温反应炉:
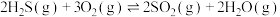
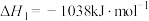
催化转化器:
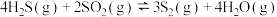

①总反应式
 的
的
 。
。②催化转化器中,提高硫回收率的措施可以是
③催化转化器内温度一般控制在170~350℃,过低不利于回收硫,其原因是
(2)真空
 —克劳斯法联合脱硫。用过量
—克劳斯法联合脱硫。用过量 溶液吸收少量
溶液吸收少量 ,其离子方程式为
,其离子方程式为 的
的 ,
, ;
; 的
的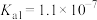 ,
,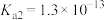 )
)(3)最新先进方法,使用金属硫化物作光催化分解
 制氢的催化剂。但过程伴随复杂的氧化进程,生成多种氧化产物。
制氢的催化剂。但过程伴随复杂的氧化进程,生成多种氧化产物。①在相同条件下,使用不同催化剂测得的数据制图如下。其中催化效率较好的是

②根据题意,相比克劳斯工艺,光催化分解
 的优点是
的优点是
您最近一年使用:0次



