解题方法
1 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和,因此 的综合利用成为研究热点。
的综合利用成为研究热点。
(1)通过捕捉空气中的 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
,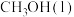 的燃烧热为726
的燃烧热为726 ,反应
,反应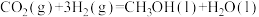 的
的
_______  。
。
(2)利用电喷雾电离等方法可得 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: 与
与 反应的能量变化曲线为
反应的能量变化曲线为_______ (填“c”或“d”),写出 与
与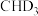 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:_______ 或_______ 。
(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ: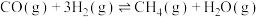
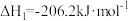
反应Ⅱ: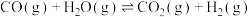
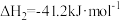
反应皿: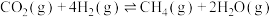
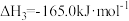
T℃时,向恒容密闭容器中充入一定量的 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率 及
及 和
和 的物质的量
的物质的量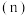 随
随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线是
变化的曲线是_______ (填“a”、“b”、“c”或“d”);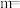
_______ ; 的选择性
的选择性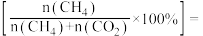
_______ 。
②已知起始充入1mol 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
_______ (用含 的代数式表示)。
的代数式表示)。
 的综合利用成为研究热点。
的综合利用成为研究热点。(1)通过捕捉空气中的
 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
,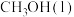 的燃烧热为726
的燃烧热为726 ,反应
,反应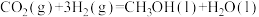 的
的
 。
。(2)利用电喷雾电离等方法可得
 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: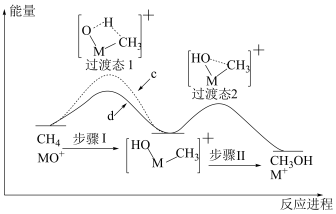
 与
与 反应的能量变化曲线为
反应的能量变化曲线为 与
与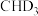 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:
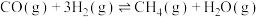
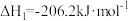
反应Ⅱ:
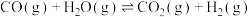
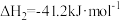
反应皿:
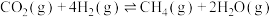
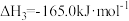
T℃时,向恒容密闭容器中充入一定量的
 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率 及
及 和
和 的物质的量
的物质的量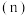 随
随 变化的情况如图所示。
变化的情况如图所示。
 变化的曲线是
变化的曲线是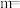
 的选择性
的选择性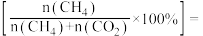
②已知起始充入1mol
 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
解题方法
2 . 我国科学家根据 在HZSM-5载体上的单层分散行为设计催化剂用于
在HZSM-5载体上的单层分散行为设计催化剂用于 选择性还原
选择性还原 。回答下列问题:
。回答下列问题:
已知:①
 kJ⋅mol
kJ⋅mol (
( )
)
②
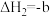 kJ⋅mol
kJ⋅mol (
( )
)
(1)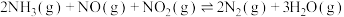

______ kJ⋅mol 。
。
(2)向恒容密闭容器中充入0.4 mol 和0.6 mol
和0.6 mol ,只发生反应①。下列叙述正确的是______(填标号)。
,只发生反应①。下列叙述正确的是______(填标号)。
(3)一定温度下,起始投料不变,单位时间内氮氧化物转化率、表面活泼氧量比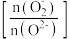 与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是
与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是______ (填具体催化剂名称)。 、2 mol
、2 mol  和4 mol
和4 mol  ,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。______ 。
②a→b段氮氧化物转化率变化的原因是____________ 。
③M点反应______ (填“达到”或“未达到”)平衡状态,判断依据是______ ,M→N段氮氧化物转化率变化的原因可能是____________ 。
(5)一定温度下,向体积为1 L的恒容密闭容器中充入1 mol 和2 mol
和2 mol ,在催化剂作用下发生反应:①
,在催化剂作用下发生反应:①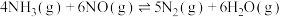 :②
:②
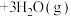 达到平衡时,NO转化率为70%,
达到平衡时,NO转化率为70%, 的选择性为50%[
的选择性为50%[ 的选择性
的选择性 ]该温度下,反应①的平衡常数
]该温度下,反应①的平衡常数
______ mol·L (列出计算式即可)。
(列出计算式即可)。
 在HZSM-5载体上的单层分散行为设计催化剂用于
在HZSM-5载体上的单层分散行为设计催化剂用于 选择性还原
选择性还原 。回答下列问题:
。回答下列问题:已知:①

 kJ⋅mol
kJ⋅mol (
( )
)②

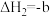 kJ⋅mol
kJ⋅mol (
( )
)(1)
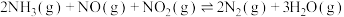

 。
。(2)向恒容密闭容器中充入0.4 mol
 和0.6 mol
和0.6 mol ,只发生反应①。下列叙述正确的是______(填标号)。
,只发生反应①。下列叙述正确的是______(填标号)。| A.恒温条件下,压强不随时间变化时反应达到平衡状态 |
B.平衡时温度不变,再充入1 mol  时平衡常数减小 时平衡常数减小 |
| C.反应达到平衡时放出的热量为0.1a kJ |
| D.加入高效催化剂,反应达到平衡时NO的转化率增大 |
(3)一定温度下,起始投料不变,单位时间内氮氧化物转化率、表面活泼氧量比
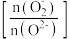 与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是
与催化剂组成类型的关系如下图所示。催化效能最佳的催化剂组成是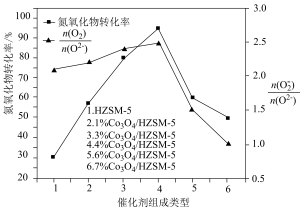
 、2 mol
、2 mol  和4 mol
和4 mol  ,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
,在不同组成的催化剂作用下,单位时间内氮氧化物的转化率与温度的关系如下图所示。
②a→b段氮氧化物转化率变化的原因是
③M点反应
(5)一定温度下,向体积为1 L的恒容密闭容器中充入1 mol
 和2 mol
和2 mol ,在催化剂作用下发生反应:①
,在催化剂作用下发生反应:①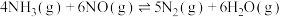 :②
:②
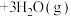 达到平衡时,NO转化率为70%,
达到平衡时,NO转化率为70%, 的选择性为50%[
的选择性为50%[ 的选择性
的选择性 ]该温度下,反应①的平衡常数
]该温度下,反应①的平衡常数
 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
名校
解题方法
3 .  与生产、环境有着密切的关系,回答下列问题:
与生产、环境有着密切的关系,回答下列问题:
(1)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: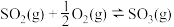 ,钒催化剂参与反应的能量变化如图所示,
,钒催化剂参与反应的能量变化如图所示,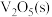 与
与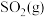 反应生成
反应生成 和
和 的热化学方程式为:
的热化学方程式为:___________ 。 的催化氧化反应在不同压强下进行,
的催化氧化反应在不同压强下进行, 平衡转化率
平衡转化率 随温度的变化如图所示,
随温度的变化如图所示,
___________  (填>或
(填>或 ),判断的依据是
),判断的依据是___________ 。 置入抽空的刚性容器中升高温度发生分解反应可得到
置入抽空的刚性容器中升高温度发生分解反应可得到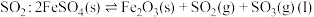 。平衡时
。平衡时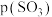 -T的关系如下图所示。
-T的关系如下图所示。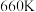 时,该反应的平衡常数
时,该反应的平衡常数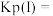
___________ 。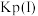 随反应温度升高而
随反应温度升高而___________ (填“增大”“减小”或“不变”)。
②提高温度,上述容器中进一步发生反应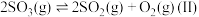 ,平衡时
,平衡时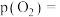
___________ [用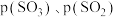 表示]。在
表示]。在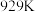 时,
时,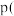 总
总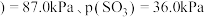 ,则
,则
___________  。
。
 与生产、环境有着密切的关系,回答下列问题:
与生产、环境有着密切的关系,回答下列问题:(1)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: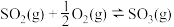 ,钒催化剂参与反应的能量变化如图所示,
,钒催化剂参与反应的能量变化如图所示,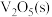 与
与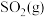 反应生成
反应生成 和
和 的热化学方程式为:
的热化学方程式为: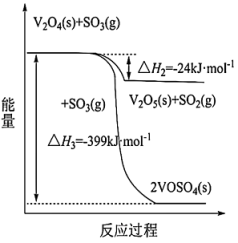
 的催化氧化反应在不同压强下进行,
的催化氧化反应在不同压强下进行, 平衡转化率
平衡转化率 随温度的变化如图所示,
随温度的变化如图所示,
 (填>或
(填>或 ),判断的依据是
),判断的依据是
 置入抽空的刚性容器中升高温度发生分解反应可得到
置入抽空的刚性容器中升高温度发生分解反应可得到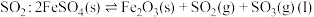 。平衡时
。平衡时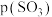 -T的关系如下图所示。
-T的关系如下图所示。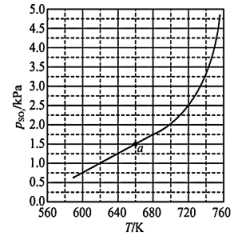
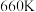 时,该反应的平衡常数
时,该反应的平衡常数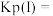
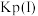 随反应温度升高而
随反应温度升高而②提高温度,上述容器中进一步发生反应
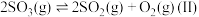 ,平衡时
,平衡时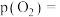
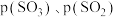 表示]。在
表示]。在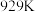 时,
时,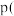 总
总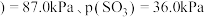 ,则
,则
 。
。
您最近半年使用:0次
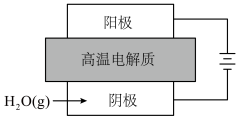
4 . 氢气是一种清洁能源,研究制氢技术具有重要意义。
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。___________ (用电极反应式表示)。
②电解质常选用铈( )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为___________ 。 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是___________ 。
(2)乙醇-水催化重整可获得 。其主要反应为:
。其主要反应为:
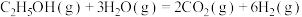
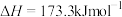

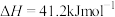
在 、
、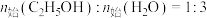 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。 的
的
___________  。
。
②平衡时, 的产率随温度的变化为
的产率随温度的变化为___________ 。
(3)在“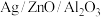 ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。 的
的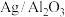 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是___________ 。
ii.若用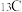 标记乙醇
标记乙醇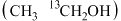 ,最终产物中含
,最终产物中含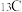 的物质化学式为
的物质化学式为___________ 。
(1)一种高温固体氧化物电解水制氢原理如图所示。通过施加高温下的电压,使电解质中的
 从阴极一侧迁移到阳极一侧,同时氧化为
从阴极一侧迁移到阳极一侧,同时氧化为 。
。
②电解质常选用铈(
 )的氧化物,晶胞结构如图所示,其化学式为
)的氧化物,晶胞结构如图所示,其化学式为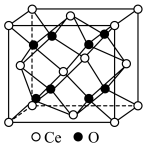
 进入
进入 氧化物晶格后(
氧化物晶格后( 取代部分
取代部分 ),电解效率显著提升,其原因是
),电解效率显著提升,其原因是(2)乙醇-水催化重整可获得
 。其主要反应为:
。其主要反应为: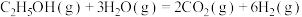
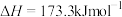

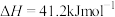
在
 、
、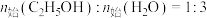 时,若仅考虑上述反应,平衡时
时,若仅考虑上述反应,平衡时 和
和 的转化率随温度的变化如图所示。
的转化率随温度的变化如图所示。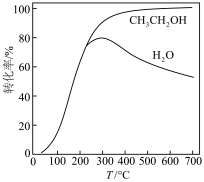
 的
的
 。
。②平衡时,
 的产率随温度的变化为
的产率随温度的变化为(3)在“
 ”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。
”催化作用下,乙醇-水催化重整中部分物种变化路径如图所示。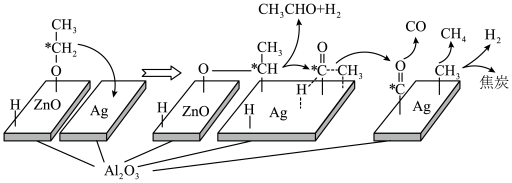
 的
的 催化剂几乎没有催化活性的原因可能是
催化剂几乎没有催化活性的原因可能是ii.若用
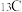 标记乙醇
标记乙醇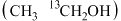 ,最终产物中含
,最终产物中含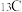 的物质化学式为
的物质化学式为
您最近半年使用:0次
名校
解题方法
5 . 亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得: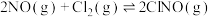 。
。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①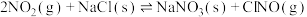

②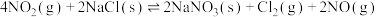

③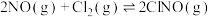
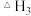
则
__________ ;
(2)若向绝热恒容密闭容器中充入物质的量之比为2:1的NO和Cl2进行反应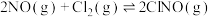 能判断反应已达到化学平衡状态的是
能判断反应已达到化学平衡状态的是__________ (填序号):
a.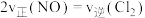 b.气体的平均相对分子质量保持不变
b.气体的平均相对分子质量保持不变
c.NO和Cl2的体积比保持不变 d.体系温度不变
(3)在催化剂作用下,亚硝酰氯(ClNO)的合成原料NO可以转化为无毒气体: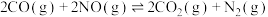
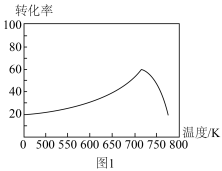
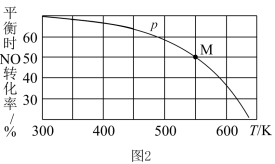
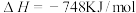 ,一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
,一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是____________ 。
(4)按投料比2:1把NO和Cl2加入到一恒压密闭容器中发生反应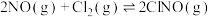 ,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示:①该反应的
,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示:①该反应的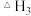
____________ (填“>”“<”或“=”)0,在____________ (填“高温”或“低温”)下能自发进行。
②在p压强条件下,M点时容器内NO的体积分数为__________ 。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数
___________ (用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
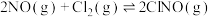 。
。(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酸氯,涉及如下反应:
①
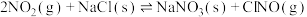

②
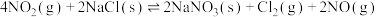

③
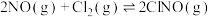
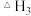
则

(2)若向绝热恒容密闭容器中充入物质的量之比为2:1的NO和Cl2进行反应
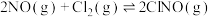 能判断反应已达到化学平衡状态的是
能判断反应已达到化学平衡状态的是a.
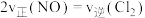 b.气体的平均相对分子质量保持不变
b.气体的平均相对分子质量保持不变c.NO和Cl2的体积比保持不变 d.体系温度不变
(3)在催化剂作用下,亚硝酰氯(ClNO)的合成原料NO可以转化为无毒气体:
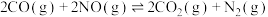
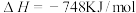 ,一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
,一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是(4)按投料比2:1把NO和Cl2加入到一恒压密闭容器中发生反应
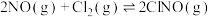 ,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示:①该反应的
,平衡时NO的转化率与温度T、压强p(总压)的关系如图2所示:①该反应的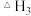
②在p压强条件下,M点时容器内NO的体积分数为
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数

您最近半年使用:0次
名校
6 . 甲醇是一种理想的储氢载体,我国科学家研发的全球首套千吨级太阳能燃料舍成项目被形象地称为“液态阳光”计划。该计划利用太阳能电解水产生氢气,然后将二氧化碳与氢气转化为甲醇,以实现“碳中和”的目的。生产甲醇的过程主要发生以下反应:
①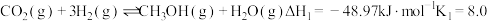
②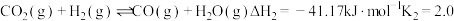
③
(1)反应③的活化能E(正)_______ E(逆)(填“>”“<”或“=”),该反应在_______ (填“高温”或“低温”)条件下自发进行。
(2)当只发生以上反应时,单位时间内反应物的投料与 的转化率、
的转化率、 的产率之间关系如下表。
的产率之间关系如下表。
甲醇的选择率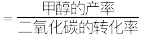 。若单纯从选择率角度看,上表中氢气与二氧化碳的最佳投料比应为_______(填字母)。
。若单纯从选择率角度看,上表中氢气与二氧化碳的最佳投料比应为_______(填字母)。
(3)工业生产对催化剂进行选择的时候,除了要考虑催化剂的效率以外,催化剂的稳定性也是很重要的参考条件,一般工业生产所用催化剂更换间隔为半年到一年,请根据下图信息,选出最适合的催化剂为_______(填字母)。
(4)在恒温密闭容器中,往容器中注入一定量 和
和 发生以上反应,若反应达到平衡时CO和
发生以上反应,若反应达到平衡时CO和 的浓度相等,则平衡时
的浓度相等,则平衡时 的浓度为
的浓度为_______  。
。
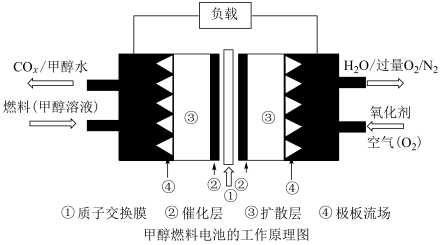
(5)通过设计燃料电池(如图),可以将甲醇中蕴藏的能量释放出来,在酸性电解质溶液中,甲醇在电极上反应产生碳氧化物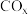 。
。_______ 。
①
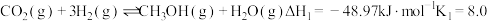
②
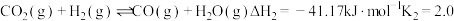
③

(1)反应③的活化能E(正)
(2)当只发生以上反应时,单位时间内反应物的投料与
 的转化率、
的转化率、 的产率之间关系如下表。
的产率之间关系如下表。 | 2:1 | 3:1 | 5:1 | 7:1 |
 的转化率% 的转化率% | 11.6 | 13.7 | 15.9 | 18.7 |
 的产率% 的产率% | 3.0 | 4.1 | 5.3 | 6.9 |
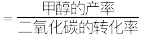 。若单纯从选择率角度看,上表中氢气与二氧化碳的最佳投料比应为_______(填字母)。
。若单纯从选择率角度看,上表中氢气与二氧化碳的最佳投料比应为_______(填字母)。| A.2:1 | B.3:1 | C.5:1 | D.7:1 |
(3)工业生产对催化剂进行选择的时候,除了要考虑催化剂的效率以外,催化剂的稳定性也是很重要的参考条件,一般工业生产所用催化剂更换间隔为半年到一年,请根据下图信息,选出最适合的催化剂为_______(填字母)。
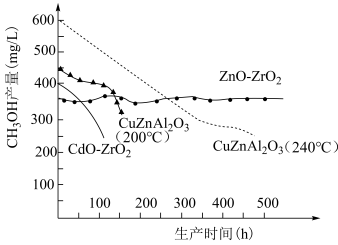
A. | B. (200℃) (200℃) |
C. (240℃) (240℃) | D. |
(4)在恒温密闭容器中,往容器中注入一定量
 和
和 发生以上反应,若反应达到平衡时CO和
发生以上反应,若反应达到平衡时CO和 的浓度相等,则平衡时
的浓度相等,则平衡时 的浓度为
的浓度为 。
。(5)通过设计燃料电池(如图),可以将甲醇中蕴藏的能量释放出来,在酸性电解质溶液中,甲醇在电极上反应产生碳氧化物
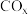 。
。
您最近半年使用:0次
名校
解题方法
7 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼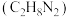 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
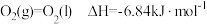 ;
;
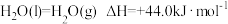 ;
;
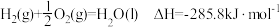 。
。
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为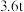 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示. 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A.OH- B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
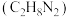 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
;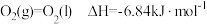 ;
;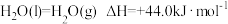 ;
;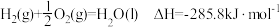 。
。请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
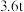 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.
①该转化过程中,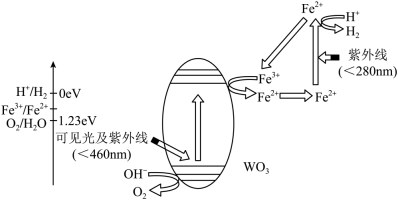
 转化为
转化为 的催化剂是
的催化剂是A.OH- B.
 C.
C. D.紫外线
D.紫外线
您最近半年使用:0次
名校
8 . 空间站处理 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
Ⅰ.固态胺吸收与浓缩
在水蒸气存在下固态胺吸收 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。
Ⅱ. 的加氢甲烷化
的加氢甲烷化
 还原
还原 制
制 的部分反应如下:
的部分反应如下:
i.CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2 CH4(g)+H2O(g)
CH4(g)+H2O(g) 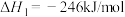
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
___________  。
。
(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是___________ ;
a.容器中混合气体密度不变 b.混合气体中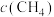 与
与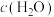 之比不变
之比不变
c.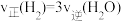 d.容器内温度不变
d.容器内温度不变
Ⅲ.和 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: 转化率仍在上升,其原因是
转化率仍在上升,其原因是___________ 。
(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是___________ ,使用的合适温度为___________ 。
(5)控制起始时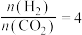 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:___________ (填增大,减小或者不变)。
②图中代表 的曲线是
的曲线是___________ (填“a”、“b”或“c”);温度低于500℃时,CO的物质的量分数约为0,说明此条件下,反应___________ (填“i”或“ii”)化学平衡常数大,反应完全。
③反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
___________  (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
 的一种重要方法是对
的一种重要方法是对 进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:
进行收集和再生处理,重新生成可供人体呼吸的氧气。其技术路线可分为以下三步:Ⅰ.固态胺吸收与浓缩

在水蒸气存在下固态胺吸收
 反应生成酸式碳酸盐(该反应是放热反应),再解吸出
反应生成酸式碳酸盐(该反应是放热反应),再解吸出 的简单方法是加热。
的简单方法是加热。Ⅱ.
 的加氢甲烷化
的加氢甲烷化 还原
还原 制
制 的部分反应如下:
的部分反应如下:i.CO2(g)+H2(g)
 CO(g)+H2O(g)
CO(g)+H2O(g) 
ii.CO(g)+3H2
 CH4(g)+H2O(g)
CH4(g)+H2O(g) 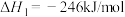
(1)反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的
CH4(g)+2H2O(g)的
 。
。(2)向恒容绝热的密闭容器中充入amolCO与2amolH2,进行反应ii,下列能判断反应已达化学平衡状态的是
a.容器中混合气体密度不变 b.混合气体中
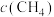 与
与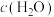 之比不变
之比不变c.
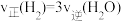 d.容器内温度不变
d.容器内温度不变Ⅲ.和
 合成甲烷也是资源化利用的重要方法。对于上述(1)的反应
合成甲烷也是资源化利用的重要方法。对于上述(1)的反应 ,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成
,催化剂的选择是甲烷化技术的核心。在两种不同催化剂条件下反应相同时间,测得转化率和生成 选择性随温度变化的影响如下图所示:
选择性随温度变化的影响如下图所示: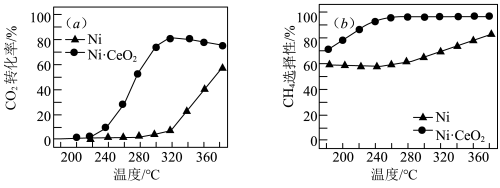
 转化率仍在上升,其原因是
转化率仍在上升,其原因是(4)对比上述两种催化剂的催化性能,工业上应选择的催化剂是
(5)控制起始时
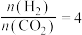 ,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示:
,P=1atm,恒容条件下,若只发生反应i、ii,平衡时各物质的量分数随温度的变化如图所示: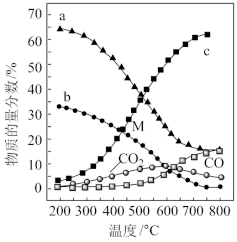
②图中代表
 的曲线是
的曲线是③反应CO2(g)+4H2(g)
 CH4(g)+2H2O(g)的平衡常数
CH4(g)+2H2O(g)的平衡常数
 (用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
(用平衡分压代替平衡浓度计算,分压总压物质的量分数)。
您最近半年使用:0次
7日内更新
|
374次组卷
|
4卷引用:宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题
宁夏石嘴山市光明中学2024届高三第一次模拟考试理综化学试题(已下线)题型11 反应原理综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练09 化学反应原理综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
名校
9 . I.已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
(1)CO 的空间结构是
的空间结构是_______ 。
(2) 溶液呈
溶液呈_______ (填“酸性”“碱性”或“中性”)。
(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH由小到大 排列的顺序是_______ 。(填序号)
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:_______ 。
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:

反应2:
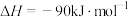
(5)则反应3: 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为_______ 。
(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。_______ 。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根( )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为_______ 、_______ 。
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.810−5 | Kal=4.310−7、Ka2=5.610−11 | Ka=3.010−8 |
 的空间结构是
的空间结构是(2)
 溶液呈
溶液呈(3)物质的量浓度均为0.1mol·L−1的下列四种溶液:pH
①CH3COONa②Na2CO3③NaClO④NaHCO3
(4)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
II.为实现“双碳”目标,用二氧化碳制备甲醇可实现二氧化碳资源化利用、降低碳排放。回答下列问题:
已知:反应1:


反应2:

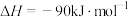
(5)则反应3:
 催化加氢制取
催化加氢制取 的热化学方程式为
的热化学方程式为(6)反应2的反应历程如下图所示,其中吸附在催化剂表面的物种用*标注。
III.为了探究电解池的工作原理,某研究性学习小组用下图所示的装置进行实验。实验时该小组同学发现两极均有气体产生,且Y极处溶液逐渐变成紫红色;停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(
 )在溶液中呈紫红色。
)在溶液中呈紫红色。
(7)电解过程中,Y极发生的电极反应为
您最近半年使用:0次
解题方法
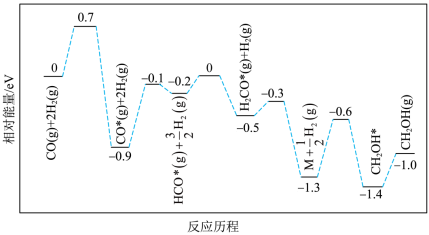
10 . 甲烷干重整(DRM)是利用 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
Ⅰ.
Ⅱ.
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为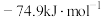 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为_______  。
。
(2)甲烷和二氧化碳的起始物质的量均为 ,实验测得在
,实验测得在 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。_______ mol,反应Ⅱ的压强平衡常数
_______ 。
②为了消除积碳带来的影响,反应选择在_______ (填“高温”或“低温”)下进行。
(3)在不同压强下,按照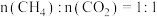 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为________ 。
②压强 、
、 、
、 、
、 由小到大的顺序为
由小到大的顺序为________ 。
③ ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是________ 。
 和
和 在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:
在催化剂的作用下制备合成气,作为可持续替代燃料。DRM的主要反应为:Ⅰ.
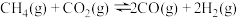
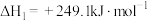
Ⅱ.

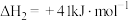
该过程中还伴随积碳反应的发生。
(1)一定压强下,由最稳定单质生成
 化合物的焓变为该物质的摩尔生成焓。已知
化合物的焓变为该物质的摩尔生成焓。已知 、
、 的摩尔生成焓分别为
的摩尔生成焓分别为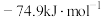 、
、 。则
。则 的摩尔生成焓为
的摩尔生成焓为 。
。(2)甲烷和二氧化碳的起始物质的量均为
 ,实验测得在
,实验测得在 下,平衡时各组分的量随温度变化如图所示。
下,平衡时各组分的量随温度变化如图所示。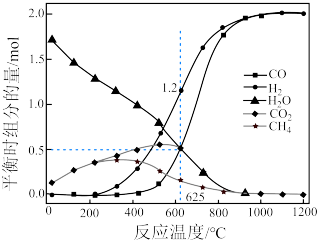

②为了消除积碳带来的影响,反应选择在
(3)在不同压强下,按照
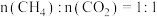 投料,假设只发生反应Ⅰ和Ⅱ。
投料,假设只发生反应Ⅰ和Ⅱ。 的平衡转化率随温度的变化关系如图所示。
的平衡转化率随温度的变化关系如图所示。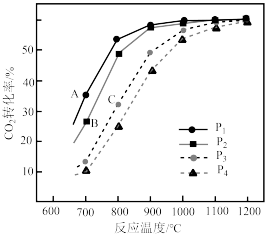
 、
、 、
、 ,三者由大到小顺序为
,三者由大到小顺序为②压强
 、
、 、
、 、
、 由小到大的顺序为
由小到大的顺序为③
 ,四条曲线几乎交于一点的原因是
,四条曲线几乎交于一点的原因是
您最近半年使用:0次



