I.
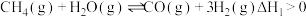
II.
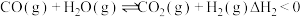
回答下列问题:
(1)在恒温恒容密闭容器中充入
 和
和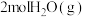 ,发生上述反应。下列叙述正确的是___________(填字母)。
,发生上述反应。下列叙述正确的是___________(填字母)。| A.平衡后,增大压强,反应Ⅰ的平衡常数减小 |
| B.平衡后,升高温度,两个反应都向左移动 |
C.平衡后,充入惰性气体, 的平衡转化率增大 的平衡转化率增大 |
D.其他条件不变,增大 浓度,两个反应的正反应速率均增大 浓度,两个反应的正反应速率均增大 |
(2)写出
 和
和 反应生成
反应生成 和
和 的热化学方程式:
的热化学方程式: 用
用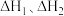 的关系式表示)。
的关系式表示)。(3)
 和水蒸气反应的能量变化如图所示。
和水蒸气反应的能量变化如图所示。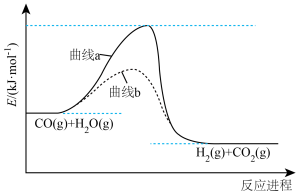
已知:i.
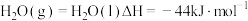 。
。ii.
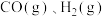 的燃烧热
的燃烧热 分别为
分别为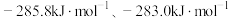 。
。①启动该反应需要加热,其主要作用是
A.降低活化能 B.改变反应历程
C.增大反应物能量 D.增大产物能量
②图中代表加入催化剂的曲线是
③
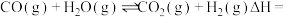
 。
。
相似题推荐
【推荐1】(1)3.2g硫完全燃烧生成稳定的氧化物放出297.2kJ,写出硫燃烧热的热化学方程式:
(2)氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)△H;已知每破坏1mol有关化学键需要的能量如下表:
2NH3(g)△H;已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N |
435.9kJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=
(3)在某一容积为2L的恒容密闭容器中,A、B、C、D四种气体物质发生可逆反应,其物质的量n(mol)随时间t(min)的变化曲线如图所示。回答下列问题:
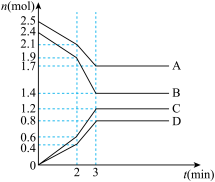
①该反应的化学方程式为
②在2min时,图像发生改变的原因可能是
A.增大B的物质的量B.降低温度
C.加入催化剂D.减小A的物质的量
③不同条件下的该反应的速率:①v(A)=1.0mol·L-1·s-1,②v(B)=1.0 mol·L-1·s-1,③v(C)=1.2 mol·L-1·s-1,④v(D)=1.2mol·L-1·s-1。其中反应速率最快的是
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式:
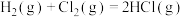
 kJ·mol
kJ·mol ;该反应属于
;该反应属于(2)常温常压下,1 mol乙醇完全燃烧生成
 气体和液态水放出的热量为1367kJ,写出乙醇燃烧热的热化学方程式:
气体和液态水放出的热量为1367kJ,写出乙醇燃烧热的热化学方程式:(3)根据盖斯定律计算
 (白磷,s)
(白磷,s)
 kJ·mol
kJ·mol ①
①P(红磷,s)

 kJ·mol
kJ·mol ②
②则白磷转化为红磷的热化学方程式为
(4)已知破坏1 mol
 键、1 mol
键、1 mol 键、1mol
键、1mol 键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出
键分别需要吸收的能量为436kJ、151kJ、299kJ。则由氢气和碘单质反应生成2molHI需要放出(5)已知①


②


③


利用上述三个反应,计算

 的反应焓变为
的反应焓变为 、
、 、
、 的式子表示)
的式子表示)(6)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: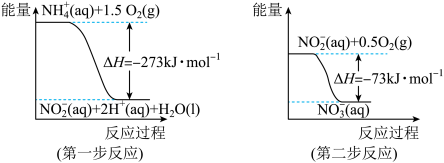
①第一步反应是
②1 mol
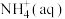 全部氧化成
全部氧化成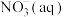 的热化学方程式是
的热化学方程式是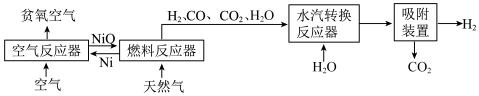
回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:
②K1、K2、K3之间的关系是:
③在
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为
 的捕集、利用已成为科学家研究的热点。
的捕集、利用已成为科学家研究的热点。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:主反应Ⅰ:

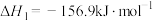
副反应Ⅱ:


(1)
 的
的
 ,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在
,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(2)若在恒容绝热的容器中只发生副反应Ⅱ,下列能说明该反应一定达到平衡状态的是___________。
| A.容器内气体密度不再改变 |
| B.容器内的压强不再改变 |
C.容器内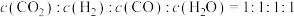 |
| D.单位时间内,断开H-H键的数目和断开H-O键的数目之比为1∶2 |
 和
和 ,若只发生主反应Ⅰ,测得在相同时间内,不同温度下
,若只发生主反应Ⅰ,测得在相同时间内,不同温度下 的转化率如图所示,已知
的转化率如图所示,已知 时已达平衡状态。
时已达平衡状态。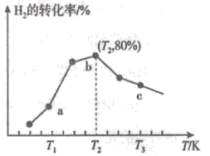
①a点

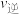 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②c点的转化率比b点低的原因是
③温度为
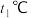 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得:
充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得: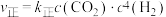 、
、 ,
, 、
、 为速率常数。温度为
为速率常数。温度为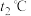 ,达平衡时:
,达平衡时: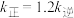 ,则
,则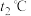
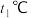 。
。(4)500℃时,向IL恒容密闭容器中充入
 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
 ;500℃,副反应Ⅱ的压强平衡常数Kp=
;500℃,副反应Ⅱ的压强平衡常数Kp=(1)已知:①
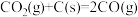 ΔH1
ΔH1②
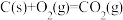 ΔH2
ΔH2③
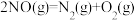 ΔH3
ΔH3则
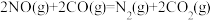 的ΔH=
的ΔH=(2)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为
 ΔH<0。其他条件相同,在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如下图。
ΔH<0。其他条件相同,在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如下图。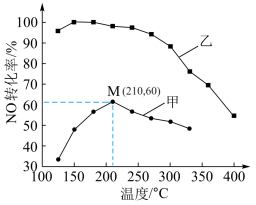
①工业上选择催化剂
②在催化剂甲作用下,图中M点NO的转化率
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的NO
 ,其工作原理如下图所示。
,其工作原理如下图所示。
①导电基体Pt颗粒
 上NO
上NO 发生的电极反应式为
发生的电极反应式为②在单原子铜、铂催化作用下,H2转化NO
 为N2的过程可描述为
为N2的过程可描述为①2Li(s)+H2(g)═2LiH(s)△H=﹣182kJ•mol﹣1;
②2H2(g)+O2(g)═2H2O(1)△H═﹣572kJ•mol﹣1;
③4Li(s)+O2(g)═2Li2O(s)△H═﹣1196kJ•mol﹣1。
(1)写出LiH在O2中燃烧的热化学方程式
Ⅱ.中和热是指酸跟碱发生中和反应生成1mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.他将50mL 0.5mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
(2)从实验装置上看,图中尚缺少的一种玻璃用品是
(3)大烧杯上如不盖硬纸板,则求得的中和热数值
(4)实验中改用60mL 0.50mol/L的盐酸跟50mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所求中和热的数值会
(5)设50mL 0.5mol/L的盐酸与50mL 0.55mol/L的NaOH溶液反应的反应热为△H1,25mL 0.5mol/L的浓硫酸与50mL 0.55mol/L的NaOH溶液反应的反应热为△H2,50mL 0.5mol/L的醋酸与50mL 0.55mol/L的NaOH溶液反应的反应热为△H3,则△H1、△H2、△H3的关系是
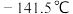 ,沸点
,沸点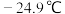 ,与石油液化气
,与石油液化气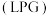 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
相似,被誉为“21世纪的清洁燃料”。制备原理如下:(I)由天然气催化制备二甲醚:①
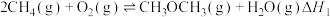 ;
;(II)由合成气制备二甲醚:
②
 ;
;③
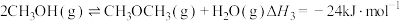 。
。回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是
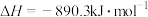 和
和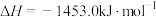 ;1mol液态水变为气态水要吸收
;1mol液态水变为气态水要吸收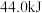 的热量。则
的热量。则
 。
。(2)反应③的化学平衡常数表达式为

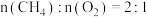 混合,图中能正确反映反应①中
混合,图中能正确反映反应①中 的平衡体积分数随温度变化的曲线是
的平衡体积分数随温度变化的曲线是 填字母
填字母 。
。A.混合气体的密度不变
B.反应容器中二甲醚的百分含量不变
C.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
D.混合气体的压强不变

(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和
 ,此时体系总压强是
,此时体系总压强是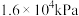 。8min达到平衡,平衡时CO浓度为
。8min达到平衡,平衡时CO浓度为 ,
,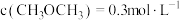 ,则CO的转化率为
,则CO的转化率为
 分压
分压 总压
总压 物质的量分数
物质的量分数 。
。(4)在500K时的2L的密闭容器中充入
 ,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡,
,发生反应③,容器的总压强为4000kPa,反应5min后达到平衡, ,用单位时间甲醇的分压变化表示该反应的反应速率为
,用单位时间甲醇的分压变化表示该反应的反应速率为 在溶液中主要以
在溶液中主要以 (蓝紫色)、
(蓝紫色)、 (绿色)、
(绿色)、 (橙红色)、
(橙红色)、 (黄色)等形式存在。
(黄色)等形式存在。 为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:
为难溶于水的灰蓝色固体,可与强酸、强碱反应。回答下列问题:(1)在
 溶液中逐滴加入
溶液中逐滴加入 溶液直至过量,可观察到的现象是
溶液直至过量,可观察到的现象是(2)
 和
和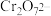 在溶液中可相互转化
在溶液中可相互转化 。室温下,初始浓度为
。室温下,初始浓度为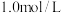 的
的 溶液中
溶液中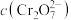 随
随 的变化如图所示。
的变化如图所示。
①由图可知,溶液酸性增强,
 的平衡转化率
的平衡转化率②升高温度,溶液中
 的平衡转化率减小,则该反应的
的平衡转化率减小,则该反应的
(3)+6价铬的化合物毒性较大,常用
 将废液中的
将废液中的 还原成
还原成 ,该反应的离子方程式为
,该反应的离子方程式为(1)平衡时,消耗CH3OH的物质的量为:
(2)该条件下反应达到平衡状态的依据是(填字母)
A.v正(CH3OH)=v逆(CO2)B.混合气体的密度不变
C.c(CH3OH)=c(H2O)D.混合气体的总物质的量不变
(3)升高温度该反应的平衡向
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1= +48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2= −30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH=
(3)对于反应2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。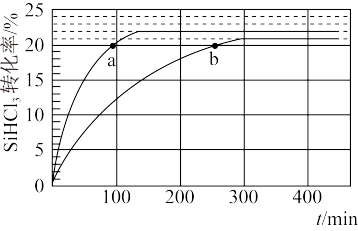
①343 K时反应的平衡转化率α=
②在343 K下,要提高SiHCl3转化率,可采取的措施是
 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。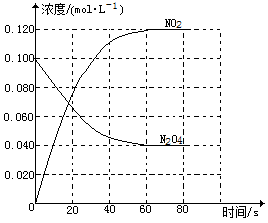
回答下列问题:
(1)反应的△H
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T
b:列式计算温度T时反应的平衡常数K2=
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向(填“正反应”或“逆反应”)
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)
 Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL0.2mol/LAgNO3溶液中;③100mL0.1mol/L氯化铝溶液中;④100mL0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL0.2mol/LAgNO3溶液中;③100mL0.1mol/L氯化铝溶液中;④100mL0.1mol/L盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 2NH3(g)△H,据此回答以下问题:
2NH3(g)△H,据此回答以下问题:(1)已知每破坏l mol有关化学键需要的能量如下表:
| H-H | N-H | N-N | N≡N |
| 436 kJ | 391kJ | 193kJ | 946kJ |
则△H=
(2)在不同温度、压强和相同催化剂条件下,初始时N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氨的体积分数(p)如图所示:
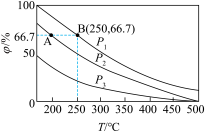
①其中,p1、p2和p3由大到小的顺序是
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)
③若在250℃、pl条件下,反应达到平衡时容器的体积为1 L,则该条件下合成氨的平衡常数K=
(3)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步N2(g) →2N*;H2(g)一2H* (慢反应)
第二步N*+H*= NH*;NH*+H*= NH2*;NH2*+H*= NH3* (快反应)
第三步NH3*= NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
(4) H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中发生反应:H2NCOONH4(s)
 2NH3(g)+CO2(g),能说明该反应达到平衡状态的是
2NH3(g)+CO2(g),能说明该反应达到平衡状态的是①混合气体的压强不变
②混合气体的密度不变
③混合气体的总物质的量不变
④混合气体的平均相对分子质量不变
⑤NH3的体积分数不变

 N
N

