解题方法
1 . 氮及其化合物与人们的生活生产密切相关。回答下列问题:
(1)微生物作用下,废水中的NH 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:
Ⅰ步:2 NH (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
Ⅱ步:2NO (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。
则低浓度氨氮废水中的NH (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=___________ kJ/mol。
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g) 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
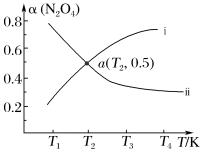
α(N2O4)随温度的变化的正确曲线是___________ (填“i”或“ii”)。若该容器中通入N2O4的起始浓度为2mol/L,则a点温度下的平衡常数K=___________ 。若加入催化剂,图中的曲线会___________ (填“上移”、“下移”或“不移”)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
则反应温度高的容器是___________ (填“甲”或“乙”);甲容器中,0~120 min的速率v(N2)=___________ mol/(L·min),达到化学平衡后,乙容器中各物质均加倍,则平衡向___________ (“正反应”或“逆反应”)方向移动。
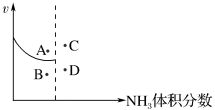
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为___________ (从点“A、B、C、D”中选择)。
(1)微生物作用下,废水中的NH
 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:Ⅰ步:2 NH
 (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/molⅡ步:2NO
 (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。则低浓度氨氮废水中的NH
 (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g)
 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:| t/min | 0 | 40 | 80 | 120 | 160 |
| n甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为

您最近一年使用:0次
2 . 我国的二氧化碳排放力争在2030年前实现“碳达峰”,2060年前实现“碳中和”。为达成这一目标,一方面要减少碳排放,另一方面要尽量吸收不可避免的碳排放。
(1)以 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:

①上述过程中,能量的变化形式是_______ 。
②写出 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式_______ 。
(2) 催化重整为吸收“碳排放”的另一个新途径,回答下列问题:
催化重整为吸收“碳排放”的另一个新途径,回答下列问题:
①已知: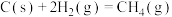





则催化重整反应

_______ (用 、
、 、
、 表示)。
表示)。
②若在恒温、恒容的密闭容器中,充入等物质的量的 和
和 ,在一定条件下发生催化重整反应,下列描述能说明该反应已经达到平衡状态的是
,在一定条件下发生催化重整反应,下列描述能说明该反应已经达到平衡状态的是_______ (填标号)。
A. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
B.混合气体的密度保持不变
C.容器中气体的压强保持不变
D.
E.混合气体的平均相对分子质量保持不变
(3)复合催化是工业利用二氧化碳合成甲醇 的重要反应,在
的重要反应,在 密闭容器中,充入
密闭容器中,充入 和
和 ,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:

①该可逆反应的化学方程式为_______ 。
②反应开始至 末,以氢气的浓度变化表示该反应的平均速率是
末,以氢气的浓度变化表示该反应的平均速率是_______  。
。
③恒温恒容时,下列措施能使该反应速率增大的是_______ (填字母,下同)。
a.增加 的浓度 b.适当降低温度 c.充入氦气 d.选择高效催化剂
的浓度 b.适当降低温度 c.充入氦气 d.选择高效催化剂
(1)以
 为催化剂的光、热化学循环分解
为催化剂的光、热化学循环分解 反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
反应,为吸收“碳排放”提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示:
①上述过程中,能量的变化形式是
②写出
 分解生成CO和
分解生成CO和 的热化学方程式
的热化学方程式(2)
 催化重整为吸收“碳排放”的另一个新途径,回答下列问题:
催化重整为吸收“碳排放”的另一个新途径,回答下列问题:①已知:
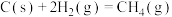





则催化重整反应


 、
、 、
、 表示)。
表示)。②若在恒温、恒容的密闭容器中,充入等物质的量的
 和
和 ,在一定条件下发生催化重整反应,下列描述能说明该反应已经达到平衡状态的是
,在一定条件下发生催化重整反应,下列描述能说明该反应已经达到平衡状态的是A.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变B.混合气体的密度保持不变
C.容器中气体的压强保持不变
D.

E.混合气体的平均相对分子质量保持不变
(3)复合催化是工业利用二氧化碳合成甲醇
 的重要反应,在
的重要反应,在 密闭容器中,充入
密闭容器中,充入 和
和 ,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
,在催化剂、200℃的条件下发生反应。部分反应物和产物随时间变化如图所示:
①该可逆反应的化学方程式为
②反应开始至
 末,以氢气的浓度变化表示该反应的平均速率是
末,以氢气的浓度变化表示该反应的平均速率是 。
。③恒温恒容时,下列措施能使该反应速率增大的是
a.增加
 的浓度 b.适当降低温度 c.充入氦气 d.选择高效催化剂
的浓度 b.适当降低温度 c.充入氦气 d.选择高效催化剂
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题:
(1)已知化学反应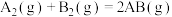 的能量变化如图所示:
的能量变化如图所示:

①该反应的
___________ 0(填“大于”“小于”或“等于”)。
②写出该反应的热化学方程式___________ 。
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①
②
③
④
上述反应热效应之间的关系式为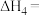
___________ ,联氨和 可作为火箭推进剂的主要原因为
可作为火箭推进剂的主要原因为___________ 。(至少答两条)
(3)合成氨工业在工农业生产、生活中有着重要作用。反应原理为 。在
。在 时,将一定物质的量的
时,将一定物质的量的 和
和 置于一压强不变的密闭容器中。
置于一压强不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是___________ (填序号)。
a.容器内的压强不再随时间变化 b.
c. 正
正 逆
逆 d.混合气体的密度保持不变
d.混合气体的密度保持不变
②上述反应达到平衡后,其他条件不变,升高温度, 逆
逆___________ (填“增大”“不变”或“减小”), 正和
正和 逆的关系为
逆的关系为 正
正___________  逆(填“>”“=”或“<”),最后二者相等。
逆(填“>”“=”或“<”),最后二者相等。
(4)在 时,将
时,将 和
和 置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是
置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是___________ 。

a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,再充入 和
和
d.保持温度、压强不变,移出少量氨气
(1)已知化学反应
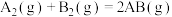 的能量变化如图所示:
的能量变化如图所示:
①该反应的

②写出该反应的热化学方程式
(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:①

②

③

④

上述反应热效应之间的关系式为
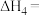
 可作为火箭推进剂的主要原因为
可作为火箭推进剂的主要原因为(3)合成氨工业在工农业生产、生活中有着重要作用。反应原理为
 。在
。在 时,将一定物质的量的
时,将一定物质的量的 和
和 置于一压强不变的密闭容器中。
置于一压强不变的密闭容器中。①下列各项能说明该反应已达到平衡状态的是
a.容器内的压强不再随时间变化 b.

c.
 正
正 逆
逆 d.混合气体的密度保持不变
d.混合气体的密度保持不变②上述反应达到平衡后,其他条件不变,升高温度,
 逆
逆 正和
正和 逆的关系为
逆的关系为 正
正 逆(填“>”“=”或“<”),最后二者相等。
逆(填“>”“=”或“<”),最后二者相等。(4)在
 时,将
时,将 和
和 置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是
置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可是
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,再充入
 和
和
d.保持温度、压强不变,移出少量氨气
您最近一年使用:0次
名校
4 .  和
和 均是洁净的能源和重要的化工原料。
均是洁净的能源和重要的化工原料。
Ⅰ.甲烷高温分解可制碳黑,设计成燃料电池可提高能量的利用效率。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量。则该条件下 完全燃烧的热化学方程式为
完全燃烧的热化学方程式为___________ 。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是___________ 。
(3)已知某甲烷燃料电池的总反应为 ,则电池负极的电极反应为
,则电池负极的电极反应为___________ ,随着电池不断放电,负极附近溶液的pH___________ 。(填“增大”、“减小”或“不变”)
Ⅱ.利用工业废气或大气捕获的 制备甲醇(
制备甲醇( ),可减轻对化石燃料的依赖。
),可减轻对化石燃料的依赖。
实验室在体积为2L的密闭容器中充入1mol 和3mol
和3mol 在催化剂作用下通过反应
在催化剂作用下通过反应
 制备甲醇,实验测得
制备甲醇,实验测得 和
和 的物质的量随时间的变化关系如图所示。
的物质的量随时间的变化关系如图所示。
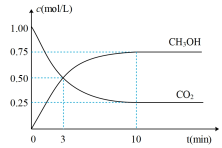
(4)由图可知,当反应进行到___________ (填“3min”或“10min”)时,正反应速率和逆反应速率恰好相等。
(5)下列情况能说明该反应达到化学平衡状态的是___________ (填字母)。
a.单位时间内消耗1mol 的同时生成1mol
的同时生成1mol
b. 与
与 的物质的量之比不再发生变化
的物质的量之比不再发生变化
c.混合气体的密度不再发生变化
(6)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量___________ (填“增多”“减少”或“不变”)。
 和
和 均是洁净的能源和重要的化工原料。
均是洁净的能源和重要的化工原料。Ⅰ.甲烷高温分解可制碳黑,设计成燃料电池可提高能量的利用效率。
(1)已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.64kJ热量。则该条件下
 完全燃烧的热化学方程式为
完全燃烧的热化学方程式为(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(3)已知某甲烷燃料电池的总反应为
 ,则电池负极的电极反应为
,则电池负极的电极反应为Ⅱ.利用工业废气或大气捕获的
 制备甲醇(
制备甲醇( ),可减轻对化石燃料的依赖。
),可减轻对化石燃料的依赖。实验室在体积为2L的密闭容器中充入1mol
 和3mol
和3mol 在催化剂作用下通过反应
在催化剂作用下通过反应
 制备甲醇,实验测得
制备甲醇,实验测得 和
和 的物质的量随时间的变化关系如图所示。
的物质的量随时间的变化关系如图所示。
(4)由图可知,当反应进行到
(5)下列情况能说明该反应达到化学平衡状态的是
a.单位时间内消耗1mol
 的同时生成1mol
的同时生成1mol
b.
 与
与 的物质的量之比不再发生变化
的物质的量之比不再发生变化c.混合气体的密度不再发生变化
(6)若上述反应中生成水的总物质的量不变,但水为液态,则反应过程中放出的热量
您最近一年使用:0次
2023-05-16更新
|
93次组卷
|
2卷引用:陕西省宝鸡中学2023年高一下学期期末测试化学试题
名校
解题方法
5 . 氢能是一种极具发展潜力的清洁能源。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
(2)氢能是一种极具发展潜力的清洁能源,图中是一种以太阳能为热源,高效无污染的制氢方法。
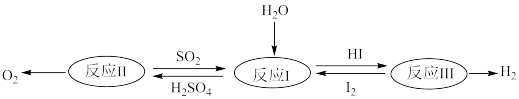
该过程实现了太阳能向_____ 能的转化,反应I的化学方程式为______ 。
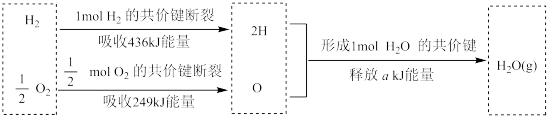
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是____ ,计算a=_____ 。
(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+ O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2
C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系___________ 。
(1)氢能是一种既高效又干净的新能源,发展前景良好,用氢能作能源的燃料电池汽车是研究的重点方向之一、下列说法正确的是___________(填字母)。
| A.氢燃料电池中H2在正极反应,O2在负极反应 |
| B.理论上氢能源汽车使用时不会产生污染物 |
| C.氢燃料电池可以将化学能完全转化为电能 |
| D.水分解产生氢气的同时放出热量供汽车使用 |

该过程实现了太阳能向
(3)已知1 mol H2完全燃烧生成H2O(g)放出245 kJ能量。根据如图信息,H与H2比较,较稳定的是

(4)已知:Fe2O3(s) + 3C(石墨)=2Fe(s) + 3CO(g) △H1
CO(g)+
 O2(g)=CO2(g) △H2
O2(g)=CO2(g) △H2C(石墨)+O2(g)=CO2(g) △H3
2Fe2O3(s)=4Fe(s)+3O2(g) △H4
请写出△H4与△H1、△H2、 △H3的关系
您最近一年使用:0次
名校
解题方法
6 . 甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
Ⅰ甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa 时,1mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出 5518kJ 热量。该反应的热化学方程式为:_____
(2)已知:25℃,101KPa 时,CH3OH(l)+ 3/2 O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1
相同质量的甲醇和辛烷分别燃烧时,放出热量最多的是_____ (填化学式)
(3)CH3OH(l)+ O2(g)=CO(g)+2H2O(g) ΔH=-393 kJ·mol-1该反应相关化学键键能数据如下表:
则 X=_____ 。
Ⅱ甲醇的合成
(4)以 CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。
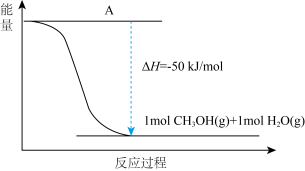
①补全上图:图中A 处应填入_____ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应 ΔH_____ (填“变大”“变小”“不变”)。
③已知:
CO(g)+ 1/2 O2(g) = CO2(g) ΔH1=-283kJ·mol-1
H2(g)+ 1/2 O2(g) = H2O(g)ΔH2=-242kJ·mol-1
CH3OH(g)+ 3/2 O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
以 CO(g)和 H2(g)为原料合成甲醇的反应为 CO(g)+ 2H2(g) = CH3OH(g),该反应的 ΔH=_____ kJ·mol-1。
Ⅰ甲醇可以替代汽油和柴油作为内燃机燃料
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃,101KPa 时,1mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出 5518kJ 热量。该反应的热化学方程式为:
(2)已知:25℃,101KPa 时,CH3OH(l)+ 3/2 O2(g)=CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1
相同质量的甲醇和辛烷分别燃烧时,放出热量最多的是
(3)CH3OH(l)+ O2(g)=CO(g)+2H2O(g) ΔH=-393 kJ·mol-1该反应相关化学键键能数据如下表:
| 化学键 | O=O | C-O | C=O | H-O | C-H |
| E/( kJ·mol-1) | X | 343 | 1076 | 465 | 413 |
Ⅱ甲醇的合成
(4)以 CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如图所示。

①补全上图:图中A 处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应 ΔH
③已知:
CO(g)+ 1/2 O2(g) = CO2(g) ΔH1=-283kJ·mol-1
H2(g)+ 1/2 O2(g) = H2O(g)ΔH2=-242kJ·mol-1
CH3OH(g)+ 3/2 O2(g)=CO2(g)+2H2O(g) ΔH3=-676 kJ·mol-1
以 CO(g)和 H2(g)为原料合成甲醇的反应为 CO(g)+ 2H2(g) = CH3OH(g),该反应的 ΔH=
您最近一年使用:0次
2020-09-30更新
|
113次组卷
|
3卷引用:陕西省延安市第四中学(宝塔中学)2020-2021学年高一下学期期末考试化学试题
解题方法
7 . 工业上用CO生产燃料甲醇。一定温度和容积条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
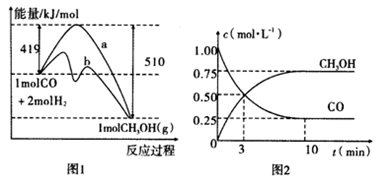
请回答下列问题:
(1)在“图1”中,曲线_________ (填“a”或“b”)表示使用了催化剂;没有使用催化剂时,在该温度和压强条件下反应CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=_____________ 。
(2)下列说法正确的是__________ 。
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=____________ ;达到平衡时,c(H2)=_________ ,该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为
CH3OH(g)的化学平衡常数为______________ 。达到平衡后若保持其它条件不变,将容器体积压缩为0.5L,则平衡___________ 移动 (填“正向”、“逆向”或“不”)(4)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g);ΔH=-193kJ/mol。又知H2O(l)= H2O(g)ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式___________________________________________________ 。
(5)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198,Cl—Cl :243,P—Cl:331。

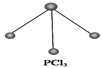
则反应P4(白磷,s)+6Cl2(g) 4PCl3(s)的反应热ΔH=
4PCl3(s)的反应热ΔH=____________________ 。
 CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中的能量变化;图2表示一定温度下,在体积为1L的密闭容器中加入2mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)下列说法正确的是
A.起始充入的CO的物质的量为1mol
B.增加CO的浓度,H2的转化率会增大
C.容器中压强恒定时,反应达到平衡状态
(3)从反应开始到建立平衡,v(CO)=
 CH3OH(g)的化学平衡常数为
CH3OH(g)的化学平衡常数为(5)已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198,Cl—Cl :243,P—Cl:331。


则反应P4(白磷,s)+6Cl2(g)
 4PCl3(s)的反应热ΔH=
4PCl3(s)的反应热ΔH=
您最近一年使用:0次



