1 . 中国科学家设计构建了结构封装双钯活性位点—纳米“蓄水”膜反应器,实现了 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:
(1)已知乙醇、氢气的标准燃烧热 分别为
分别为 、
、 ,则反应
,则反应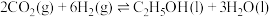 的
的
___________  ,该反应在
,该反应在___________ (填“高温下”“低温下”或“任何温度下均”)有利于自发进行。
(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:___________ 。
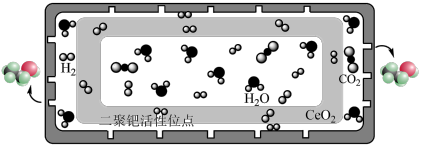
(3)在一恒压密闭容器中充入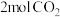 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性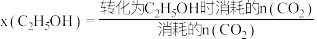 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
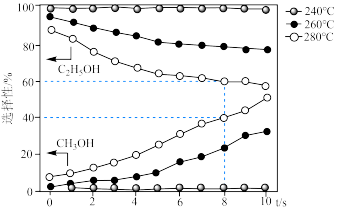
①在 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为___________ 。
② 下,
下, 内
内 的转化率为
的转化率为___________ %,氢气分压的平均变化率为___________  。
。
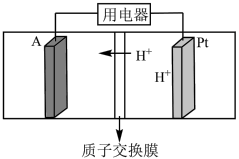
(4)酸性 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为___________ (填化学式), 极的电极反应式为
极的电极反应式为___________ 。
 一步无副反应高效稳定制乙醇。回答下列问题:
一步无副反应高效稳定制乙醇。回答下列问题:(1)已知乙醇、氢气的标准燃烧热
 分别为
分别为 、
、 ,则反应
,则反应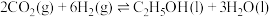 的
的
 ,该反应在
,该反应在(2)结构封装双钯活性位点—纳米“蓄水”膜反应器结构(如图所示)类似于一个胶囊,胶囊内部封装了二氧化铈载体分散的双钯催化剂,胶囊的壳层具有高选择性、疏水性,可及时分离出产物乙醇。该反应器可使
 高效稳定地转化为乙醇,请分析可能原因:
高效稳定地转化为乙醇,请分析可能原因:
(3)在一恒压密闭容器中充入
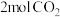 、
、 ,发生主反应I
,发生主反应I 、副反应II
、副反应II 。已知初始压强为
。已知初始压强为 ,反应
,反应 时,测得
时,测得 下,总共生成
下,总共生成 水。甲醇与乙醇的选择性[如
水。甲醇与乙醇的选择性[如 的选择性
的选择性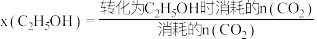 ]随温度和反应时间的变化关系如图。
]随温度和反应时间的变化关系如图。
①在
 下,当温度为
下,当温度为 时,乙醇的选择性能保持在近
时,乙醇的选择性能保持在近 的水平,但温度为
的水平,但温度为 和
和 时选择性大幅下降,其原因可能为
时选择性大幅下降,其原因可能为②
 下,
下, 内
内 的转化率为
的转化率为 。
。(4)酸性
 燃料电池的装置图如图所示,A极输入的物质为
燃料电池的装置图如图所示,A极输入的物质为 极的电极反应式为
极的电极反应式为
您最近一年使用:0次
2024-03-31更新
|
123次组卷
|
2卷引用:2024届陕西省榆林市高三上学期第一次模拟检测理综试题-高中化学
2 . 研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为_________________________________ 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________________________________ 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH______ 0(填“>”、“<”或“=”)。

③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_____ KⅡ(填“>”、“<”或“=”)。判断的理由__________________ 。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为______________ 。开始以氨碳比=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为____________ 。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Kb=4.3×10-7,则NH4HCO3溶液呈________ (填“酸性”、“中性”、“碱性”)。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) =" 2Fe(s)" + 3CO(g) △H 1 =" +489.0" kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 =" +172.5" kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H①该反应的平衡常数表达式为K=
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH

③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Kb=4.3×10-7,则NH4HCO3溶液呈
您最近一年使用:0次
3 . CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。回答下列问题:
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。

CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为____ 。
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式___________ 。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为____ 。
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:

①反应过程中,表明反应达到平衡状态的标志是______ ;
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1___ T2 (填“<”、“=”或“>”)。
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为____ ,保持T1和此时容器的容积不变,再充入1mol CO2和3mol H2,设达到平衡时CO2的总转化率为a,写出一个能够解出a的方程或式子 ___ (不必化简,可以不带单位)。
(1)制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。

CH4 (g)与H2O(g)反应生成CO(g)和H2 (g)的热化学方程式为
(2)工业乙醇也可用CO和H2合成,常含一定量甲醇,各国严禁使用成本低廉的工业酒精勾兑食用酒,但一般定性的方法很难检测出食用酒中的甲醇。有人就用硫酸酸化的橙色K2Cr2O7溶液定量测定混合物中甲醇的含量,甲醇与酸性K2Cr2O7溶液反应生成CO2、Cr2(SO4)3等物质,写出其化学方程式
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体混合物通过足量的碱石灰,碱石灰 增重4. 08 g,又知生成CO2和H2O的物质的量之比为3:4。则M中碳、氢、氧原子个数之比为
(4) CO2和H2合成甲醇涉及以下反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H=-49.58kJ/mol。在反应过程中可以在恒压的密闭容器中,充入一定量的CO2和H2,测得不同温度下,体系中CO2的平衡转化率与压强的关系曲线如图所示:

①反应过程中,表明反应达到平衡状态的标志是
A.生成3mol O-H键,同时断裂3mol H-H键 B.容器中气体的压强不再变化
C.容器中气体的平均摩尔质量不变 D.CH3OH的浓度不再改变
②比较T1与T2的大小关系:T1
③在T1和P2的条件下,向密闭容器中充入1mol CO2和3mol H2,该反应在第5 min时达到平衡,此时容器的容积为2.4 L,则该反应在此温度下的平衡常数为
您最近一年使用:0次
2020-04-10更新
|
395次组卷
|
3卷引用:陕西省商洛中学2020届高三第三次模拟考试化学试题



