解题方法
1 . 苯乙烯是一种很重要的有机化学原料,用途十分广泛。在以水蒸气做稀释剂、存在催化剂的条件下,乙苯催化脱氢可生成苯乙烯。可能发生如下两个反应;
主反应: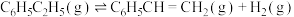
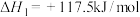 ;
;
副反应: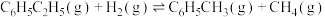
 。
。
回答下列问题:
(1)已知,在 、
、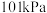 条件下,
条件下,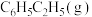 、
、 、
、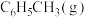 、
、 的燃烧热分别为
的燃烧热分别为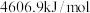 、
、 、
、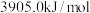 、
、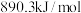 。则
。则
_______ 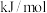 。
。
(2)在某温度、pkPa的条件下,向反应器中充入 气态乙苯发生主反应:
气态乙苯发生主反应: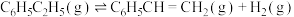 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至_______ 。
(3)在不同的温度条件下,以水烃比 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应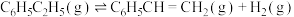 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: 移出率
移出率
 ×100%。
×100%。
①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
_______ (用含 、b、p的代数式表示)。
、b、p的代数式表示)。
②乙苯的平衡转化率增长百分数与 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:
高温下副反应程度极小,试说明当温度高于950℃时,乙苯的平衡转化率随 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:_______ 。
③下列说法正确的是_______ (填选项字母)。
A.生成 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等
B.因为 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应
C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态
(4)有研究者发现,在 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:_______ 。
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是_______ (写一点即可)。
③从资源综合利用角度分析, 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是_______ 。
主反应:
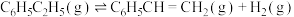
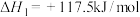 ;
;副反应:
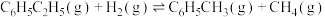
 。
。回答下列问题:
(1)已知,在
 、
、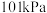 条件下,
条件下,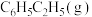 、
、 、
、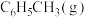 、
、 的燃烧热分别为
的燃烧热分别为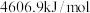 、
、 、
、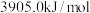 、
、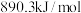 。则
。则
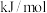 。
。(2)在某温度、pkPa的条件下,向反应器中充入
 气态乙苯发生主反应:
气态乙苯发生主反应: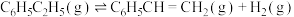 ,其平衡转化率为50%,若向该反应器中充入
,其平衡转化率为50%,若向该反应器中充入 水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至
水蒸气作为稀释气(计算时忽略副反应),可将平衡转化率提高至(3)在不同的温度条件下,以水烃比
 投料,在膜反应器中发生乙苯催化脱氢反应
投料,在膜反应器中发生乙苯催化脱氢反应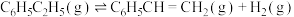 。膜反应器可以通过多孔膜移去
。膜反应器可以通过多孔膜移去 ,提高乙苯的平衡转化率,工作原理如图所示:
,提高乙苯的平衡转化率,工作原理如图所示: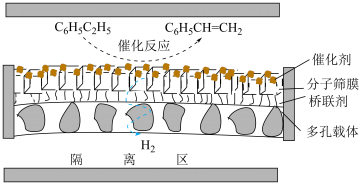
 移出率
移出率
 ×100%。
×100%。①忽略副反应,维持体系总压强p恒定,在温度T时,已知乙苯的平衡转化率为
 ,
, 的移出率为b,则在该温度下主反应的平衡常数
的移出率为b,则在该温度下主反应的平衡常数
 、b、p的代数式表示)。
、b、p的代数式表示)。②乙苯的平衡转化率增长百分数与
 的移出率在不同温度条件下的关系如表所示:
的移出率在不同温度条件下的关系如表所示:| 温度/℃ 增长百分数/%  移出率/% 移出率/% | 700 | 950 | 1000 |
| 60 | 8.43 | 4.38 | 2.77 |
| 80 | 16.8 | 6.1 | 3.8 |
| 90 | 27 | 7.1 | 4.39 |
 的移出率的变化改变程度不大的原因:
的移出率的变化改变程度不大的原因:③下列说法正确的是
A.生成
 的总物质的量与苯乙烯相等
的总物质的量与苯乙烯相等B.因为
 被分离至隔离区,故反应器中不发生副反应
被分离至隔离区,故反应器中不发生副反应C.在恒容的膜反应器中,其他条件不变,增大水烃比,可提高乙苯的转化率
D.当
 的分压不再发生变化时,说明主副反应均达到平衡状态
的分压不再发生变化时,说明主副反应均达到平衡状态(4)有研究者发现,在
 气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示:
气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图所示: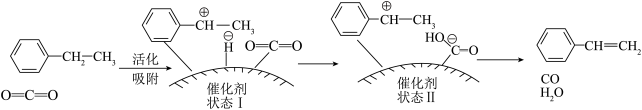
②根据反应历程分析,催化剂表面酸碱性对乙苯脱氢反应影响较大,如果催化剂表面碱性太强,会降低乙苯的转化率,碱性太强使乙苯转化率降低的原因是
③从资源综合利用角度分析,
 氧化乙苯脱氢制苯乙烯的优点是
氧化乙苯脱氢制苯乙烯的优点是
您最近一年使用:0次
解题方法
2 . 甲烷和乙炔(CH≡CH)在有机合成中有着广泛的用途。
(1)已知:①
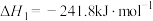
②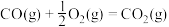

③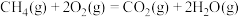
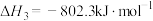
写出甲烷与水蒸气在高温下制备合成气(CO、 )的热化学方程式:
)的热化学方程式:___________ 。
(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为
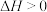 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
___________ (用气体平衡分压代替浓度计算)。
② ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入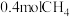 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得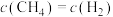 ,则
,则 的转化率为
的转化率为___________ 。若改变温度至 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
___________ (填“>”或“<”) 。
。
(3)一定温度下,向体积为2L的恒容密闭容器中充入 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: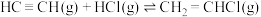
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。
___________ (填“>”“<”或“=”) 。
。
②15min时仅改变了一个外界条件,改变的条件可能是___________ 。
③0~10min内氯乙烯的平均反应速率
___________  。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是___________ 。
(1)已知:①

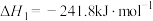
②
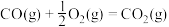

③
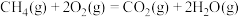
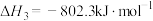
写出甲烷与水蒸气在高温下制备合成气(CO、
 )的热化学方程式:
)的热化学方程式:(2)用甲烷在高温下气相裂解制取乙炔和氢气,其反应原理为

 。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。
。几种气体平衡时分压(Pa)的对数与温度(K)的关系如图所示。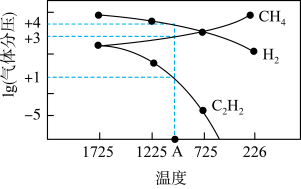

②
 ℃时,向体积为2L的恒容密闭容器中充入
℃时,向体积为2L的恒容密闭容器中充入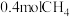 进行上述反应。当反应达到平衡时,测得
进行上述反应。当反应达到平衡时,测得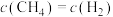 ,则
,则 的转化率为
的转化率为 ℃,10s后反应再次达到平衡,测得
℃,10s后反应再次达到平衡,测得 ,则该变化过程中
,则该变化过程中
 。
。(3)一定温度下,向体积为2L的恒容密闭容器中充入
 (乙炔)和2molHCl发生反应:
(乙炔)和2molHCl发生反应: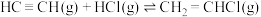
 。测得反应物(
。测得反应物( 或HCl)浓度随时间的变化关系如图所示。
或HCl)浓度随时间的变化关系如图所示。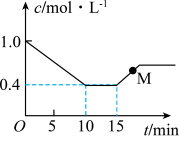

 。
。②15min时仅改变了一个外界条件,改变的条件可能是
③0~10min内氯乙烯的平均反应速率

 。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中
。向密闭容器中充入一定量乙炔和氯化氢,发生上述反应,测得乙炔的平衡转化率与温度、S的关系如图所示。其中 ,则S代表的物理量是
,则S代表的物理量是
您最近一年使用:0次
解题方法
3 . 硫酸亚铁在工农业生产中有许多用途,如可用作农药,防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题。
(1)在 气氛中,
气氛中, (
( )的脱水热分解情况如表所示:
)的脱水热分解情况如表所示:
根据上述实验结果,可知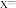
_______ 。
(2)已知下列热化学方程式:

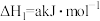

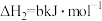


则 的
的
_______  。
。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时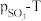 的关系如图所示。720K时,该反应的平衡总压
的关系如图所示。720K时,该反应的平衡总压
_______ kPa,平衡常数
_______ 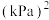 。
。 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”)。

(4)提高温度,上述容器中进一步发生反应: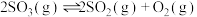 (Ⅱ),平衡时
(Ⅱ),平衡时
_______ (用 、
、 表示)。在929K时,
表示)。在929K时, ,
, ,则
,则
_______ kPa。
(1)在
 气氛中,
气氛中, (
( )的脱水热分解情况如表所示:
)的脱水热分解情况如表所示:| 加热温度/℃ | 失重比/% | 物质组成 |
| 100 | 19.4 |  |
| 200 | 38.8 |  |
| 300 | 45.3 |  |
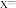
(2)已知下列热化学方程式:

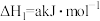

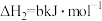


则
 的
的
 。
。(3)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: 。平衡时
。平衡时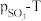 的关系如图所示。720K时,该反应的平衡总压
的关系如图所示。720K时,该反应的平衡总压

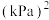 。
。 随反应温度升高而
随反应温度升高而
(4)提高温度,上述容器中进一步发生反应:
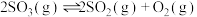 (Ⅱ),平衡时
(Ⅱ),平衡时
 、
、 表示)。在929K时,
表示)。在929K时, ,
, ,则
,则
您最近一年使用:0次
4 . 合成气是一种以H2和CO为主的化工原料气,其用途广泛、廉价、清洁,可以合成许多化工产品。
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
II.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
III.CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1
IV.CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
①△H4=______ kJ•mol-1。
②用Ni基双金属催化反应III,反应的活化能降低,△H3______ (填“变大”、“变小”或“不变”)。
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=______ mol•L-1•h-1(用含a的式子表示)。假设A为平衡态,此时压强为1MPa,则该反应的平衡常数Kp=______ (MPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:

①压强p1、p2、p3由大到小的顺序为_____ 。
②压强为p2时,随着温度升高, 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是______ 。
③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是______ (填字母)。
A.提高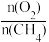 比例 B.降低
比例 B.降低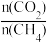 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1II.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1III.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1IV.CO2(g)+H2(g)
 CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4①△H4=
②用Ni基双金属催化反应III,反应的活化能降低,△H3
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时
 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:
①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,
 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是
A.提高
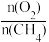 比例 B.降低
比例 B.降低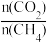 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
您最近一年使用:0次
名校
5 . 甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=_______ kJ/mol。
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。
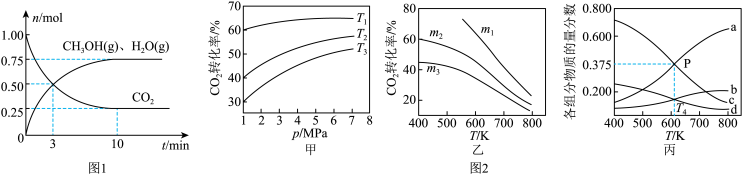
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
②下列措施不能使CO2的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=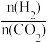 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。
①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中m1、m2、m3从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
Ⅱ.甲醇的应用
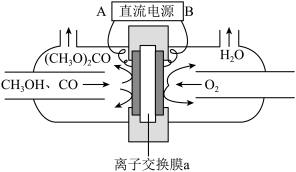
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为_______ (填“阳膜”或“阴膜”),阳极的电极反应式为_______ 。
Ⅰ﹒用CO2生产甲醇、乙醇
(1)已知:H2的燃烧热为﹣285.8kJ/mol,CH3OH(l)的燃烧热为﹣725.8kJ/mol,CH3OH(g)═CH3OH(1)△H=﹣37.3kJ/mol,则CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=
(2)为探究用CO2生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图1所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施不能使CO2的平衡转化率增大的是
A.在原容器中再充入1molCO2B.在原容器中再充入1molH2C.在原容器中充入1mol氦气
D.使用更有效的催化剂E.缩小容器的容积F.将水蒸气从体系中分离
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)═C2H5OH(g)+3H2O(g)△H<0。设m为起始时的投料比,即m=
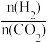 。通过实验得到如图2所示图象。
。通过实验得到如图2所示图象。①图甲中投料比相同,温度从高到低的顺序为
②图乙中m1、m2、m3从大到小的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
Ⅱ.甲醇的应用
以甲醇和CO为原料通过电化学合成碳酸二甲酯的工作原理如图所示。离子交换膜a为

您最近一年使用:0次
2020-11-15更新
|
202次组卷
|
2卷引用:陕西省汉中市龙岗学校2021届高三上学期第二次月考化学试题
6 . 氮及其化合物在工业上有重要用途。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g) 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为_________
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是______ (填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化 与
与 生成
生成 。将一定比例的
。将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
反应相同时间 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在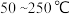 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使 去除反应速率迅速增大,上升阶段缓慢主要是
去除反应速率迅速增大,上升阶段缓慢主要是____________ ;当反应温度高于 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是_________ 。
(4)如图为利用肼 —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。
左图负极反应式为:___________ 。当上图阴极上放出2.24L气体 标准状况
标准状况 时,图中硫酸铜溶液的pH=
时,图中硫酸铜溶液的pH=______ (溶液体积变化忽略不计)。
(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=_______ mol·L-1·min-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3mol NH3,则此时反应的v正____ v逆(填“>”“<”或“=”)。
(1)已知N2(g)+O2(g)=2NO(g) ΔH =+180.5kJ·mol-1,N2(g)+3H2(g)
 2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为
2NH3(g)ΔH =-92.4kJ·mol-1,2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mol-1,写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是
2NH3(g),在恒温恒压下判断该反应达到化学平衡状态的依据是A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)在有氧条件下,新型催化剂M能催化
 与
与 生成
生成 。将一定比例的
。将一定比例的 、
、 和
和 的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。
的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图)。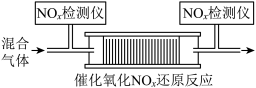
反应相同时间
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在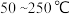 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
的去除率先迅速上升后上升缓慢,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使 去除反应速率迅速增大,上升阶段缓慢主要是
去除反应速率迅速增大,上升阶段缓慢主要是 时,
时, 的去除率迅速下降的原因可能是
的去除率迅速下降的原因可能是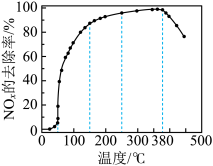
(4)如图为利用肼
 —空气燃料电池电解硫酸铜溶液的示意图。
—空气燃料电池电解硫酸铜溶液的示意图。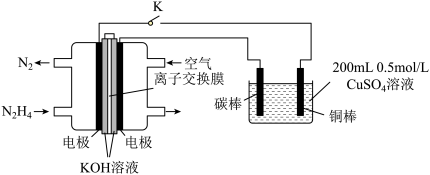
左图负极反应式为:
 标准状况
标准状况 时,图中硫酸铜溶液的pH=
时,图中硫酸铜溶液的pH=(4)工业上生产尿素的化学方程式为:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
CO(NH2)2(s)+H2O(l)。在T℃,体积为4L的密闭容器中,通入6mol NH3和3mol CO2 。10min反应达到平衡,达到平衡时,c(NH3)=0.5mol·L-1。则10min内的平均反应速率υ(CO2)=
您最近一年使用:0次
解题方法
7 . 镁、硫、氮的化合物在工业上用途非常广泛。
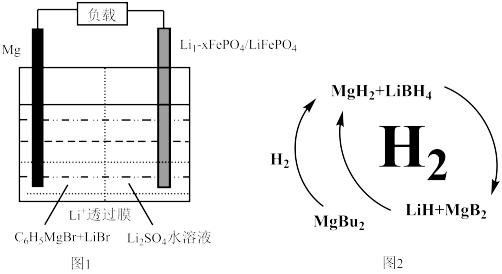
(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为_____ (填“正极”或“负极”)。
②充电时,Li+迁移至_____________ (填“阳极区”或“阴极区”)。
(2)纳米MgH2 和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为_____________________________________________ 。
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+ 2H2(g)==N2(g)+2H2O(g) △H =____ kJ·mol-1
(4)在一定条件下,反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
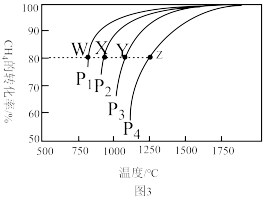
①图中p1、p2、p3、p4代表不同压强,压强最大的是_______ 。该反应的△H___ (填“>”“<”“=”下同)0。
②压强为p4时,在Y点:v(正)__________ v(逆)。
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为______ 。

(1)一种镁—锂双离子二次电池的装置如图1所示。
①放电时,Mg电极为
②充电时,Li+迁移至
(2)纳米MgH2 和LiBH4组成的体系如图2所示,400℃以上受热放氢时发生反应的化学方程式为
(3)硝酸厂尾气中含有大量的NO,可用氢气催化还原法除去NO,发生的主要反应如下:
2NO(g)+4H2(g)+O2(g)==N2(g)+4H2O(g) △H =-1143kJ·mol-1
2H2(g)+ O2(g)==2H2O(g) △H =-484kJ·mol-1
则2NO(g)+ 2H2(g)==N2(g)+2H2O(g) △H =
(4)在一定条件下,反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
2CO(g)+2H2(g)平衡时CH4的转化率与温度和压强的关系如图3所示。
①图中p1、p2、p3、p4代表不同压强,压强最大的是
②压强为p4时,在Y点:v(正)
③图中W、X、Y、Z四点对应的反应的平衡常数K1、K2、K3、K4由大到小的顺序为
您最近一年使用:0次
2018-04-03更新
|
235次组卷
|
2卷引用:陕西省榆林市2018届高三第二次模拟考试理综化学试题



