1 . 研究 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
反应I.
 ;
;
反应Ⅱ.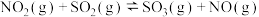
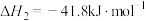 。
。
(1)则反应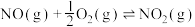

___________  ;该反应的平衡常数表达式为
;该反应的平衡常数表达式为___________ 。
(2)在某一恒容密闭容器中,通入一定量的 和
和 ,仅发生反应
,仅发生反应 :
:
①下列能说明该反应达到平衡状态的是___________ (填标号)。
A.当混合气体的密度不再随时间变化而改变时,该反应达到平衡
B.当混合气体的平均相对分子质量不再随时间变化而改变时,该反应达到平衡
C.当 不再随时间变化而改变时,该反应达到平衡
不再随时间变化而改变时,该反应达到平衡
D.当 的质量分数不再随时间变化而改变时,该反应达到平衡
的质量分数不再随时间变化而改变时,该反应达到平衡
②既能加快反应 的反应速率,又能提高
的反应速率,又能提高 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有___________ (填标号)。
A.使用合适的催化剂 B.通入适量的
C.及时抽走部分NO D.升高温度
(3) 下,在2L的恒容密闭容器中,充入
下,在2L的恒容密闭容器中,充入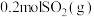 和
和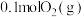 ,仅发生反应
,仅发生反应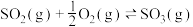 ,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
①___________ (填“低温”、“高温”或“任意温度”)下,有利于该反应自发进行。
②保持其他条件不变,仅改变温度, ,仅发生该反应,反应达到平衡时,该反应的平衡常数
,仅发生该反应,反应达到平衡时,该反应的平衡常数 ,则
,则
___________ (填“>”或“<”) 。
。
③该反应达到平衡后,保持其他条件不变,仅再通入 、
、 和
和 ,则此时
,则此时
________ (填“>”、“<”或“=”) ,判断的理由为
,判断的理由为_________ 。
 、
、 、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:
、CO等气体的无害化处理对治理大气污染、建设生态文明具有重要意义。已知:反应I.

 ;
;反应Ⅱ.
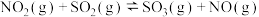
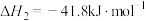 。
。(1)则反应
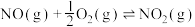

 ;该反应的平衡常数表达式为
;该反应的平衡常数表达式为(2)在某一恒容密闭容器中,通入一定量的
 和
和 ,仅发生反应
,仅发生反应 :
:①下列能说明该反应达到平衡状态的是
A.当混合气体的密度不再随时间变化而改变时,该反应达到平衡
B.当混合气体的平均相对分子质量不再随时间变化而改变时,该反应达到平衡
C.当
 不再随时间变化而改变时,该反应达到平衡
不再随时间变化而改变时,该反应达到平衡D.当
 的质量分数不再随时间变化而改变时,该反应达到平衡
的质量分数不再随时间变化而改变时,该反应达到平衡②既能加快反应
 的反应速率,又能提高
的反应速率,又能提高 的平衡转化率,可采取的措施有
的平衡转化率,可采取的措施有A.使用合适的催化剂 B.通入适量的

C.及时抽走部分NO D.升高温度
(3)
 下,在2L的恒容密闭容器中,充入
下,在2L的恒容密闭容器中,充入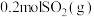 和
和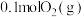 ,仅发生反应
,仅发生反应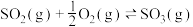 ,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:
,tmin时,该反应达到平衡,此时测得容器中混合气体的压强为起始时混合气体压强的80%:①
②保持其他条件不变,仅改变温度,
 ,仅发生该反应,反应达到平衡时,该反应的平衡常数
,仅发生该反应,反应达到平衡时,该反应的平衡常数 ,则
,则
 。
。③该反应达到平衡后,保持其他条件不变,仅再通入
 、
、 和
和 ,则此时
,则此时
 ,判断的理由为
,判断的理由为
您最近一年使用:0次
解题方法
2 . Ⅰ.氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
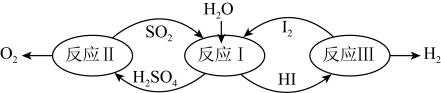
(1)已知反应Ⅱ:
它由两步反应组成:ⅰ.
ⅱ.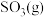 分解。
分解。
则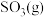 分解的热化学方程式为
分解的热化学方程式为_______ 。
(2) 、X可分别代表压强或温度其中之一、如图表示L一定时,反应ⅱ中
、X可分别代表压强或温度其中之一、如图表示L一定时,反应ⅱ中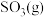 的质量分数随X的变化关系。
的质量分数随X的变化关系。
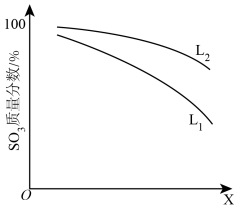
①X代表的物理量是_______ 。
②判断 的大小关系:
的大小关系:
_______  ,并简述理由:
,并简述理由:_______ 。
Ⅱ.已知 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:
回答下列问题:
(3)该反应的平衡常数表达式
_______ ,
_______ 0(填“<”“>”“=”);
(4) 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入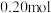 的A和
的A和 的B,如反应初始
的B,如反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时
_______  ,C的物质的量为
,C的物质的量为_______  ;若反应经一段时间后,达到平衡时A的转化率为
;若反应经一段时间后,达到平衡时A的转化率为_______ ;
(5)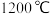 时反应
时反应 的平衡常数的值为
的平衡常数的值为_______ 。

(1)已知反应Ⅱ:

它由两步反应组成:ⅰ.

ⅱ.
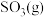 分解。
分解。则
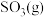 分解的热化学方程式为
分解的热化学方程式为(2)
 、X可分别代表压强或温度其中之一、如图表示L一定时,反应ⅱ中
、X可分别代表压强或温度其中之一、如图表示L一定时,反应ⅱ中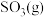 的质量分数随X的变化关系。
的质量分数随X的变化关系。
①X代表的物理量是
②判断
 的大小关系:
的大小关系:
 ,并简述理由:
,并简述理由:Ⅱ.已知
 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(3)该反应的平衡常数表达式


(4)
 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入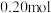 的A和
的A和 的B,如反应初始
的B,如反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时
 ,C的物质的量为
,C的物质的量为 ;若反应经一段时间后,达到平衡时A的转化率为
;若反应经一段时间后,达到平衡时A的转化率为(5)
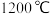 时反应
时反应 的平衡常数的值为
的平衡常数的值为
您最近一年使用:0次
3 . 合成气是一种以H2和CO为主的化工原料气,其用途广泛、廉价、清洁,可以合成许多化工产品。
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g) CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
II.CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
III.CH4(g)+H2O(g) CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1
IV.CO2(g)+H2(g) CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4
①△H4=______ kJ•mol-1。
②用Ni基双金属催化反应III,反应的活化能降低,△H3______ (填“变大”、“变小”或“不变”)。
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=______ mol•L-1•h-1(用含a的式子表示)。假设A为平衡态,此时压强为1MPa,则该反应的平衡常数Kp=______ (MPa)2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:

①压强p1、p2、p3由大到小的顺序为_____ 。
②压强为p2时,随着温度升高, 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是______ 。
③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是______ (填字母)。
A.提高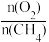 比例 B.降低
比例 B.降低 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
(1)由CH4、CO2制合成气的主要反应有:
I.CH4(g)+2O2(g)
 CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1
CO2(g)+2H2O(g) △H1=-820.6kJ•mol-1II.CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3kJ•mol-1
2CO(g)+2H2(g) △H2=+247.3kJ•mol-1III.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H3=+206.1kJ•mol-1
CO(g)+3H2(g) △H3=+206.1kJ•mol-1IV.CO2(g)+H2(g)
 CO(g)+H2O(g) △H4
CO(g)+H2O(g) △H4①△H4=
②用Ni基双金属催化反应III,反应的活化能降低,△H3
(2)一定条件下,向1L密闭容器中充入等物质的量的CO2和CH4,在催化剂作用下只发生反应II,反应控制其它条件不变,改变温度(T)对合成气中甲烷质量分数的影响如图:

若充入amolCH4,经过2小时后达到A点,2小时内用CH4表示的平均反应速率v(CH4)=
(3)不同温度下,向体积为VL的含少量O2的密闭容器中按照n(CO2):n(CH4)=1投料,实验测得平衡时
 随温度(T)的变化关系如图1所示:
随温度(T)的变化关系如图1所示:
①压强p1、p2、p3由大到小的顺序为
②压强为p2时,随着温度升高,
 先增大后减小。解释温度Tm前后,随着温度升高
先增大后减小。解释温度Tm前后,随着温度升高 变化的原因分别是
变化的原因分别是③根据图1、图2分析,为提高CO的选择性(即CO在合成气中的体积分数)可采取的措施是
A.提高
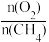 比例 B.降低
比例 B.降低 比例 C.高温、高压 D.低温、低压
比例 C.高温、高压 D.低温、低压
您最近一年使用:0次
名校
4 . 生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①:BaSO4(s)+4C(s,石墨) ⇌4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②:BaSO4(s)+4CO(g) ⇌4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________ ;
(2)已知:C(s,石墨)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol;
求CO的标准燃烧热ΔH4=_______ kJ/mol;
(3)图1为1200K下,恒容密闭容器中重晶石与石墨反应时,c(CO)随时间变化曲线图。 请分析图1曲线c(CO)在0-t2区间变化的原因:_________________ ;

(4)图2为实验测得不同温度下,反应体系中初始浓度比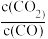 与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有________;
与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有________;
(5)图1中,t2 时刻将容器体积减小为一半,t3时刻达到新的平衡,请在图1中画出t2-t3区间c(CO)的变化曲线________________ 。
(6)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

写出阴极CO2还原为HCOO−的电极反应式:______
①:BaSO4(s)+4C(s,石墨) ⇌4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②:BaSO4(s)+4CO(g) ⇌4CO2(g)+BaS(s) ΔH2=-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:
(2)已知:C(s,石墨)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol;
求CO的标准燃烧热ΔH4=
(3)图1为1200K下,恒容密闭容器中重晶石与石墨反应时,c(CO)随时间变化曲线图。 请分析图1曲线c(CO)在0-t2区间变化的原因:

(4)图2为实验测得不同温度下,反应体系中初始浓度比
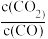 与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有________;
与固体中BaS质量分数的关系曲线。分析图2 曲线,下列说法正确的有________;| A.提高BaSO4 的投料量,可提高BaS的产率 |
| B.恒温恒容时,当混合气体的密度不变,反应①、②均达到化学平衡状态 |
C.减小初始浓度比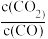 ,有利于增大BaSO4的转化率 ,有利于增大BaSO4的转化率 |
| D.适当升高温度,反应②的平衡左移,对生成BaS不利 |
(6)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。

写出阴极CO2还原为HCOO−的电极反应式:
您最近一年使用:0次
名校
解题方法
5 . 环戊烯(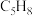 ,
, )是一种重要的有机化工原料,可用环戊二烯(
)是一种重要的有机化工原料,可用环戊二烯(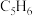 ,
,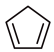 )制备。
)制备。
反应Ⅰ:
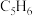 (g,环戊二烯)
(g,环戊二烯)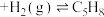 (g,环戊烯)
(g,环戊烯) 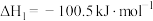
反应Ⅱ:
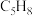 (g,环戊烯)
(g,环戊烯)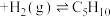 (g,环戊烷)
(g,环戊烷) 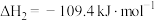
反应Ⅲ:
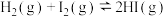
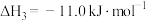
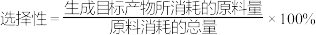
(1)某温度下,将环戊二烯和HI按物质的量之比1∶2(总物质的量为a mol)充入容积为2L的恒容密闭容器中,发生反应:
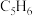 (g,环戊二烯)
(g,环戊二烯)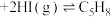 (g,环戊烯)
(g,环戊烯)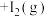 。
。①该反应的△H=
 ,该反应自发进行的条件是
,该反应自发进行的条件是②下列有关该反应的叙述正确的是
A.当气体压强不变时,说明反应已达到平衡状态
B.升高温度,有利于提高环戊烯的平衡产率
C.反应达到平衡时,环戊二烯和碘化氢的转化率相等
D.通入惰性气体,有利于提高环戊二烯的平衡转化率
(2)以Pd/
 为催化剂,如图1为25℃时环戊二烯的氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环戊烯的选择性的数据如图2所示。
为催化剂,如图1为25℃时环戊二烯的氢化过程,环戊烯与环戊烷的各组分含量(物质的量含量)随时间(t)的变化。为研究不同温度下的催化剂活性,测得不同温度(其他条件相同)下反应4h时环戊二烯的转化率和环戊烯的选择性的数据如图2所示。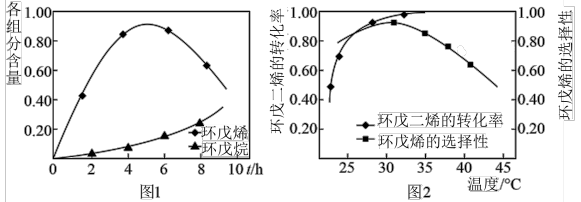
②升高温度,环戊二烯的转化率提高而环戊烯的选择性降低,其原因是
(3)已知两分子环戊二烯易发生加成反应生成二聚体双环戊二烯分子。不同温度(
 、
、 )下,在2L恒容容器中环戊二烯的物质的量与反应时间的关系如图所示(已知起始时环戊二烯的物质的量为1.5mol)。推测
)下,在2L恒容容器中环戊二烯的物质的量与反应时间的关系如图所示(已知起始时环戊二烯的物质的量为1.5mol)。推测
 (填“<”“>”或“=”);
(填“<”“>”或“=”); 时,用二聚体双环戊二烯表示0~1h的平均反应速率v=
时,用二聚体双环戊二烯表示0~1h的平均反应速率v=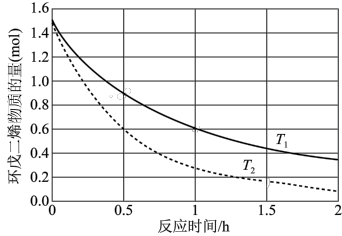


 为用各物质的平衡分压表示反应的平衡常数)。
为用各物质的平衡分压表示反应的平衡常数)。
您最近一年使用:0次
2023-08-04更新
|
188次组卷
|
3卷引用:2024届陕西省高三下学期二模理综试题-高中化学
名校
解题方法
6 . 甲烷、甲醇( )、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物,广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。
)、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物,广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。
(1)已知:①

②
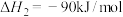
根据盖斯定律,反应 的
的
___________  ,反应能在
,反应能在___________ (填“高温”或“低温”)自发进行。
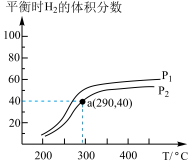
(2)工业上合成甲醇的反应: ,在一个密闭容器中,充入1molCO和
,在一个密闭容器中,充入1molCO和 发生反应,测得平衡时
发生反应,测得平衡时 的体积分数与温度、压强的关系如图所示。压强
的体积分数与温度、压强的关系如图所示。压强
___________  (填“大于”或“小于”),该反应达到平衡的标志是
(填“大于”或“小于”),该反应达到平衡的标志是___________ (填标号)。
A.反应速率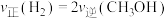
B.容器内CO和 物质的量之比为
物质的量之比为
C.混合气体的质量不再变化
D.混合气体的平均摩尔质量不再变化
(3)我国科学家制备了一种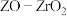 催化剂,实现
催化剂,实现 高选择性合成
高选择性合成 。气相催化合成过程中,
。气相催化合成过程中, 转化率(x)及
转化率(x)及 选择性(s)随温度的变化曲线如图。据此回答:
选择性(s)随温度的变化曲线如图。据此回答:

①生成 的最佳温度约为
的最佳温度约为___________ 。
②温度升高, 转化率升高,但产物
转化率升高,但产物 含量降低的原因:
含量降低的原因:___________ 。
(4)对于气体参与的反应如反应④[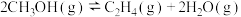 ,
, ],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的
],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的 发生反应④,在10分钟内,容器的压强由xkPa升高到ykPa,则这段时间该反应的化学反应速率
发生反应④,在10分钟内,容器的压强由xkPa升高到ykPa,则这段时间该反应的化学反应速率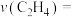
___________  。该反应的速率方程式为
。该反应的速率方程式为 ,
, ,
, 、
、 表示速率常数,与温度、活化能有关。升高温度,
表示速率常数,与温度、活化能有关。升高温度, 的变化程度
的变化程度___________ (填“大于”、或“等于”) 的变化程度。
的变化程度。
 )、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物,广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。
)、甲醛(HCHO)等含有一个碳原子的物质称为“一碳”化合物,广泛应用于化工、医药、能源等方面,研究“一碳”化合物的化学称为“一碳”化学。(1)已知:①


②

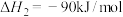
根据盖斯定律,反应
 的
的
 ,反应能在
,反应能在(2)工业上合成甲醇的反应:
 ,在一个密闭容器中,充入1molCO和
,在一个密闭容器中,充入1molCO和 发生反应,测得平衡时
发生反应,测得平衡时 的体积分数与温度、压强的关系如图所示。压强
的体积分数与温度、压强的关系如图所示。压强
 (填“大于”或“小于”),该反应达到平衡的标志是
(填“大于”或“小于”),该反应达到平衡的标志是
A.反应速率
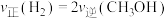
B.容器内CO和
 物质的量之比为
物质的量之比为
C.混合气体的质量不再变化
D.混合气体的平均摩尔质量不再变化
(3)我国科学家制备了一种
 催化剂,实现
催化剂,实现 高选择性合成
高选择性合成 。气相催化合成过程中,
。气相催化合成过程中, 转化率(x)及
转化率(x)及 选择性(s)随温度的变化曲线如图。据此回答:
选择性(s)随温度的变化曲线如图。据此回答:
①生成
 的最佳温度约为
的最佳温度约为②温度升高,
 转化率升高,但产物
转化率升高,但产物 含量降低的原因:
含量降低的原因:(4)对于气体参与的反应如反应④[
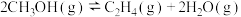 ,
, ],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的
],可以用某组分的压强(Pa)变化来表示化学反应速率,在温度和体积不变的密闭容器中充入一定量的 发生反应④,在10分钟内,容器的压强由xkPa升高到ykPa,则这段时间该反应的化学反应速率
发生反应④,在10分钟内,容器的压强由xkPa升高到ykPa,则这段时间该反应的化学反应速率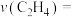
 。该反应的速率方程式为
。该反应的速率方程式为 ,
, ,
, 、
、 表示速率常数,与温度、活化能有关。升高温度,
表示速率常数,与温度、活化能有关。升高温度, 的变化程度
的变化程度 的变化程度。
的变化程度。
您最近一年使用:0次
2023-08-06更新
|
471次组卷
|
3卷引用:陕西省西安市西安中学2024届高三模拟考试(一)理综-化学试题
名校
解题方法
7 . 苯乙烯是生产塑料与合成橡胶的重要原料。CO2氧化乙苯脱氢制苯乙烯的反应为:
反应I: (g)+CO2(g)
(g)+CO2(g)
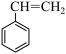 (g)+H2O(g)+CO(g) △H1
(g)+H2O(g)+CO(g) △H1
反应II: (g)
(g)
 (g)+H2(g) △H2
(g)+H2(g) △H2
反应III:CO2(g)+H2(g)=CO(g)+H2O(g) △H3=+41.2kJ•mol-1
回答下列问题:
(1)已知部分物质的燃烧热数据如表,利用表中数据计算△H2=_______ kJ•moL-1(用a、b、c表示)。
(2)下列关于反应I~III的说法正确的是_______ (填标号)。
(3)在催化剂MxOy作用下,CO2氧化乙苯脱氢制苯乙烯可能存在如图所示反应机理:
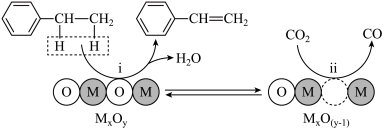
该机理可表示为以下两个反应,请补充反应ii。
i: (g)+MxOy(s)→
(g)+MxOy(s)→ (g)+MxO(y-1)(s)+H2O(g);
(g)+MxO(y-1)(s)+H2O(g);
ii:_______ 。
(4)常压下,乙苯和CO2经催化剂吸附后才能发生上述反应I。控制投料比[n(CO2)∶n(乙苯)]分别为1:1、5:1和10:1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:

①乙苯平衡转化率相同时,投料比越高,对应的反应温度越_______ (填“高”或“低”)。
②相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是:i.乙苯的浓度过低;ii._______ 。
③850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=______ mol•min-1。
(5)700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,一定条件下发生反应I,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为_______ kPa(以含有p1、p2、p的代数式表示)。[已知:①混合气体中某组分的分压等于总压与该气体物质的量分数之积;以平衡分压代替平衡浓度进行计算,可得反应的分压平衡常数Kp。②CaCO3(s)=CaO(s)+CO2(g) Kp=pkPa]
反应I:
 (g)+CO2(g)
(g)+CO2(g)
 (g)+H2O(g)+CO(g) △H1
(g)+H2O(g)+CO(g) △H1反应II:
 (g)
(g)
 (g)+H2(g) △H2
(g)+H2(g) △H2反应III:CO2(g)+H2(g)=CO(g)+H2O(g) △H3=+41.2kJ•mol-1
回答下列问题:
(1)已知部分物质的燃烧热数据如表,利用表中数据计算△H2=
| 物质 | 乙苯 | 苯乙烯 | 氢气 |
| 燃烧热用焓变表示(kJ•mol-1) | -a | -b | -c |
| A.及时分离出水蒸气,有利于提高平衡混合物中苯乙烯的含量 |
| B.n(CO2)∶n(CO)保持恒定时,说明反应I达到化学平衡状态 |
| C.其他条件相同,反应II分别在恒容和恒压条件下进行,前者乙苯的平衡转化率更高 |
| D.反应III正反应的活化能小于逆反应的活化能 |

该机理可表示为以下两个反应,请补充反应ii。
i:
 (g)+MxOy(s)→
(g)+MxOy(s)→ (g)+MxO(y-1)(s)+H2O(g);
(g)+MxO(y-1)(s)+H2O(g);ii:
(4)常压下,乙苯和CO2经催化剂吸附后才能发生上述反应I。控制投料比[n(CO2)∶n(乙苯)]分别为1:1、5:1和10:1,并在催化剂作用下发生反应,乙苯平衡转化率与反应温度的关系如图所示:

①乙苯平衡转化率相同时,投料比越高,对应的反应温度越
②相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是:i.乙苯的浓度过低;ii.
③850K时,反应经tmin达到图中P点所示状态,若初始时乙苯的物质的量为nmol,则v(苯乙烯)=
(5)700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,一定条件下发生反应I,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为
您最近一年使用:0次
8 .  重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
主反应:

副反应:
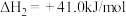
回答下列问题:
(1)已知 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、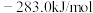 和
和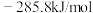 ,该催化重整主反应的
,该催化重整主反应的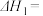
___________  。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是___________ (填标号)。
A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线 对应的
对应的
___________ ;
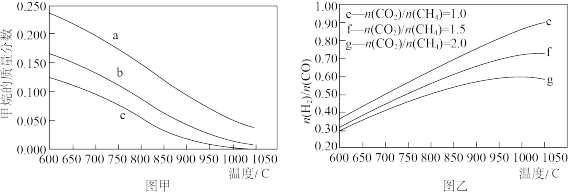
②反应体系中,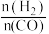 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,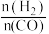 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
(3)在 、
、 时,按投料比
时,按投料比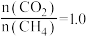 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为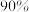 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
___________ (计算结果保留3位有效数字)。
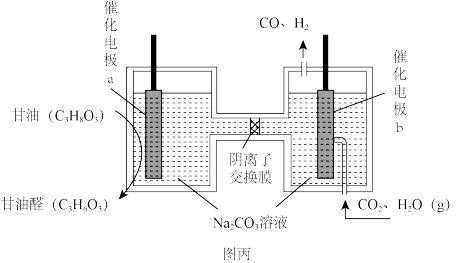
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气 和
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为___________ 极,催化电极 产生
产生 的电极反应式为
的电极反应式为___________ 。
 重整技术是实现“碳中和”的一种理想的
重整技术是实现“碳中和”的一种理想的 利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。
利用技术,具有广阔的市场前景、经济效应和社会意义。该过程中涉及的反应如下。主反应:


副反应:

回答下列问题:
(1)已知
 、
、 和
和 的燃烧热
的燃烧热 分别为
分别为 、
、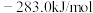 和
和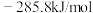 ,该催化重整主反应的
,该催化重整主反应的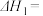
 。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是A. 高温高压 B. 高温低压 C. 低温高压 D. 低温低压
(2)在刚性密闭容器中,进料比
 分别等于1.0、1.5、2.0,且反应达到平衡状态。
分别等于1.0、1.5、2.0,且反应达到平衡状态。
①甲烷的质量分数随温度变化的关系如图甲所示,曲线
 对应的
对应的
②反应体系中,
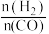 随温度变化的关系如图乙所示,随着进料比
随温度变化的关系如图乙所示,随着进料比 的增加,
的增加,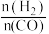 的值
的值(3)在
 、
、 时,按投料比
时,按投料比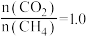 加入刚性密闭容器中,达平衡时甲烷的转化率为
加入刚性密闭容器中,达平衡时甲烷的转化率为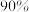 ,二氧化碳的转化率为
,二氧化碳的转化率为 ,则副反应的压强平衡常数
,则副反应的压强平衡常数
(4)我国科学家设计了一种电解装置如图丙所示,能将二氧化碳转化成合成气
 和
和 ,同时获得甘油醛。则催化电极
,同时获得甘油醛。则催化电极 为
为 产生
产生 的电极反应式为
的电极反应式为
您最近一年使用:0次
2021-04-24更新
|
857次组卷
|
6卷引用:陕西省西安市铁一中学2022届高三第二次月考化学试题
名校
9 . 含氮化合物在现代工业、环境治理中有着重要的地位。请回答下列问题:
(1)298 K和标准压强p' (101 kPa)下的反应热称为标准摩尔焓变,用 表示。现有如下反应:
表示。现有如下反应:
反应Ⅰ: 4NH3(g)+ 5O2(g)= 4NO(g)+6H2O(1) =-1169 kJ ·mol-1
=-1169 kJ ·mol-1
反应Ⅱ: 4NH3(g)+ 3O2(g)= 2N2(g)+ 6H2O(1) = -1529 kJ ·mol-1
= -1529 kJ ·mol-1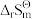 =-584 J·mol-1·K-1
=-584 J·mol-1·K-1
①反应Ⅱ___________ (填“可以”或“不可以”)自发进行。
②在298 K和p'下,由最稳定的单质生成1 mol某物质(化合物或不稳定单质)的反应热称为该物质的标准摩尔生成焓,用 表示。则NO的标准摩尔生成焓为
表示。则NO的标准摩尔生成焓为___________ kJ·mol-1。
(2)利用电解法在常温常压下合成氨,工作时,电极生成NH3的微观示意图如下,其中电解液为溶有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①生成NH3的电极反应式为___________ 。
②下列有关说法正确的是___________ (填序号)。
A.三氟甲磺酸锂的作用是增强溶液的导电性
B.该装置用金(Au)作催化剂的目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,不允许H2O进入装置
D.该装置生成NH3的一极应接电源的正极
(3)以高比表面积TiO2作载体的钒钼钛式催化剂,对NH3还原NO生成N2的反应具有较好的催化性能。
①以钒含量分别为lwt%、2wt%、3wt%,钼含量分别为6wt%、7.5wt%、 9wt%的正交实验设计的9个样品,对催化剂活性的研究结果如图甲所示(例如:1%_6%表示催化剂中钒含量为lwt%,钼含量为6wt%)。由图甲可知,随着钒含量的提高,催化剂低温活性出现逐渐___________ (填 “升高”或“降低”)的趋势,催化剂高温活性最佳组合样品配方为___________ (填图中样品组合的序号)。

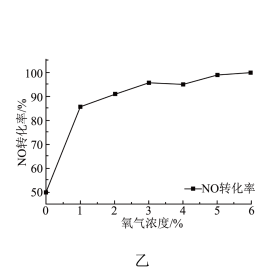
②研究氧气浓度对催化剂活性的影响,测得氧气浓度对NO转化率的影响如图乙所示。由图乙可知,随着氧气浓度的增加,催化剂的活性逐渐提高,但氧气浓度大于5%后,再增加氧气的浓度,催化剂的催化效率提升不明显的原因是___________ 。
(4)400 K时,2CO(g)+2NO(g) N2(g)+2CO2(g)在恒容容器中进行,CO和NO的初始分压均为p0 kPa,起始时容器中不含N2和CO2,达到平衡后,CO和NO的分压均为
N2(g)+2CO2(g)在恒容容器中进行,CO和NO的初始分压均为p0 kPa,起始时容器中不含N2和CO2,达到平衡后,CO和NO的分压均为  p0kPa,已知pV=nRT,则该反应在400 K时的Kc为
p0kPa,已知pV=nRT,则该反应在400 K时的Kc为___________ (用含 R和p0的式子表示)。
(1)298 K和标准压强p' (101 kPa)下的反应热称为标准摩尔焓变,用
 表示。现有如下反应:
表示。现有如下反应:反应Ⅰ: 4NH3(g)+ 5O2(g)= 4NO(g)+6H2O(1)
 =-1169 kJ ·mol-1
=-1169 kJ ·mol-1反应Ⅱ: 4NH3(g)+ 3O2(g)= 2N2(g)+ 6H2O(1)
 = -1529 kJ ·mol-1
= -1529 kJ ·mol-1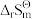 =-584 J·mol-1·K-1
=-584 J·mol-1·K-1①反应Ⅱ
②在298 K和p'下,由最稳定的单质生成1 mol某物质(化合物或不稳定单质)的反应热称为该物质的标准摩尔生成焓,用
 表示。则NO的标准摩尔生成焓为
表示。则NO的标准摩尔生成焓为(2)利用电解法在常温常压下合成氨,工作时,电极生成NH3的微观示意图如下,其中电解液为溶有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①生成NH3的电极反应式为
②下列有关说法正确的是
A.三氟甲磺酸锂的作用是增强溶液的导电性
B.该装置用金(Au)作催化剂的目的是降低N2的键能
C.选择性透过膜可允许N2和NH3通过,不允许H2O进入装置
D.该装置生成NH3的一极应接电源的正极
(3)以高比表面积TiO2作载体的钒钼钛式催化剂,对NH3还原NO生成N2的反应具有较好的催化性能。
①以钒含量分别为lwt%、2wt%、3wt%,钼含量分别为6wt%、7.5wt%、 9wt%的正交实验设计的9个样品,对催化剂活性的研究结果如图甲所示(例如:1%_6%表示催化剂中钒含量为lwt%,钼含量为6wt%)。由图甲可知,随着钒含量的提高,催化剂低温活性出现逐渐

②研究氧气浓度对催化剂活性的影响,测得氧气浓度对NO转化率的影响如图乙所示。由图乙可知,随着氧气浓度的增加,催化剂的活性逐渐提高,但氧气浓度大于5%后,再增加氧气的浓度,催化剂的催化效率提升不明显的原因是

(4)400 K时,2CO(g)+2NO(g)
 N2(g)+2CO2(g)在恒容容器中进行,CO和NO的初始分压均为p0 kPa,起始时容器中不含N2和CO2,达到平衡后,CO和NO的分压均为
N2(g)+2CO2(g)在恒容容器中进行,CO和NO的初始分压均为p0 kPa,起始时容器中不含N2和CO2,达到平衡后,CO和NO的分压均为  p0kPa,已知pV=nRT,则该反应在400 K时的Kc为
p0kPa,已知pV=nRT,则该反应在400 K时的Kc为
您最近一年使用:0次
10 . 氮是地球上含量较丰富的一种元素,氮的化合物在工业生产和生活中有重要的作用。
(1)四氧化二氮是火箭推进器的燃料,它与二氧化氮可以相互转化。一定条件下,密闭容器内发生化学反应: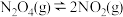 △H>0,达到平衡时,当分别改变下列某一条件,回答:
△H>0,达到平衡时,当分别改变下列某一条件,回答:
①达到平衡时,升高温度,平衡将_______ 移动(填“正向”、“逆向”或“不”)。
②达到平衡时,保持体积不变充入Ar气时,平衡将_______ 移动(填“正向”、“逆向”或“不”)。
③达到平衡时,保持容器容积不变,再通入一定量N2O4,达到平衡时NO2的百分含量_______ (填“增大”、“减小”或“不变”)。
(2)消除汽车尾气污染物中NO的反应平衡常数表达式为:
已知: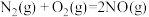
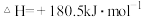
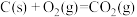
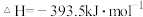
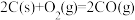
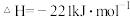
写出此反应的热化学方程式_______ ,该反应_______ (“高温”或“低温”)能自发进行。
(3)氨气是生产氮肥的主要原料,一定温度下,在体积为1L的密闭容器中充入1 mol N2和2 mol H2合成氨反应达到平衡状态时,测得N2的转化率为25%,则达平衡时该反应的中衡常数K=_______ (列出计算式)。
(1)四氧化二氮是火箭推进器的燃料,它与二氧化氮可以相互转化。一定条件下,密闭容器内发生化学反应:
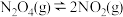 △H>0,达到平衡时,当分别改变下列某一条件,回答:
△H>0,达到平衡时,当分别改变下列某一条件,回答:①达到平衡时,升高温度,平衡将
②达到平衡时,保持体积不变充入Ar气时,平衡将
③达到平衡时,保持容器容积不变,再通入一定量N2O4,达到平衡时NO2的百分含量
(2)消除汽车尾气污染物中NO的反应平衡常数表达式为:

已知:
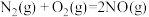
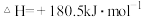
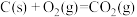
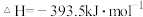
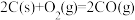
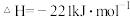
写出此反应的热化学方程式
(3)氨气是生产氮肥的主要原料,一定温度下,在体积为1L的密闭容器中充入1 mol N2和2 mol H2合成氨反应达到平衡状态时,测得N2的转化率为25%,则达平衡时该反应的中衡常数K=
您最近一年使用:0次



