1 . 2023年杭州亚运会主火炬塔首次使用废碳再生的“绿色甲醇”作为燃料,实现了循环内的零排放。“零碳甲醇”作为公认的新型清洁可再生能源,不易爆炸、储运安全便捷。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①
 kJ/mol
kJ/mol
②
 kJ/mol
kJ/mol
③

已知:甲醇的选择性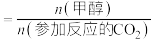
(1)
___________ ,该反应自发进行的条件是___________ 。
(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中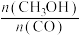 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。
(3)恒温恒容条件下,原料气 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,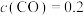 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为___________ %,该条件下反应②的
___________ (保留三位有效数字)。
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。 的电极反应式为
的电极反应式为___________ 。
(5)控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
Ⅲ.甲烷催化氧化法
主反应: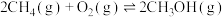
副反应: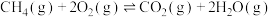
科学家将 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。___________ kJ·mol ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:___________ 。
甲醇的制备方法有二氧化碳加氢法、电催化法、甲烷催化氧化法等。回答下列问题:
Ⅰ.二氧化碳加氢制甲醇:
①

 kJ/mol
kJ/mol②

 kJ/mol
kJ/mol③


已知:甲醇的选择性
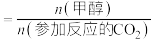
(1)

(2)一定温度下,在恒容密闭反应器中,反应③达到平衡,下列措施中能使平衡体系中
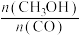 增大且加快化学反应速率的是___________ (填字母)。
增大且加快化学反应速率的是___________ (填字母)。| A.升高温度 | B.充入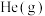 ,使体系压强增大 ,使体系压强增大 |
C.再充入1 mol | D.将 从体系中分离出去 从体系中分离出去 |
(3)恒温恒容条件下,原料气
 、
、 以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa,
以物质的量浓度之比为1∶3投料时,控制合适条件(不考虑反应③),甲醇的选择性为60%。已知初始压强为4MPa, ,达到平衡时,
,达到平衡时,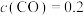 mol/L,则该过程中
mol/L,则该过程中 的平衡转化率为
的平衡转化率为
Ⅱ.电催化法
一种基于铜基金属簇催化剂电催化还原
 制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的
制备甲醇的装置如左下图所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如右下图所示。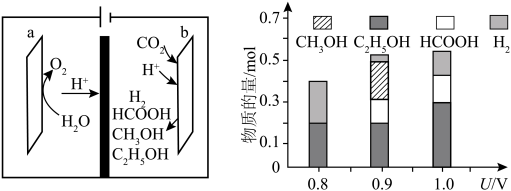
 的电极反应式为
的电极反应式为(5)控制电压为0.8V,电解时转移电子的物质的量为
Ⅲ.甲烷催化氧化法
主反应:
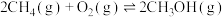
副反应:
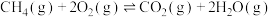
科学家将
 、
、 和
和 (
( 是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
是活性催化剂)按一定体积比在催化剂表面合成甲醇,部分反应历程如图所示(吸附在催化剂表面的物种用*标注,TS代表过渡态)。
 ,写出该步骤反应的化学方程式:
,写出该步骤反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
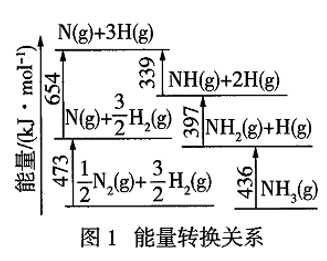
(1)Ⅰ.根据图1数据计算反应
 的
的
 。
。
Ⅱ.在一定温度、催化剂存在的条件下,密闭容器中CO与 转化为
转化为 与
与 ,相关反应如下:
,相关反应如下:
①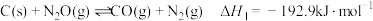
②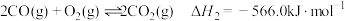
③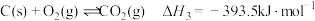
(2)则反应I:
 的
的
(3)合成氨工厂以“水煤气”和
 为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、
为原料,采用两段间接换热式绝热反应器,由进气口充入一定量含CO、 、
、 、
、 的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
的混合气体,在反应器A进行合成氨,其催化剂Ⅲ铁触媒,在500℃活性最大,反应器B中主要发生的反应为
 ,装置如图2。
,装置如图2。
①温度比较:气流a
②气体流速一定,经由催化剂Ⅰ到催化剂Ⅱ,原料转化率有提升,其可能原因是:
③下列说法正确的是
A.合成氨是目前自然固氮最重要的途径
B.利用焦炭与水蒸气高温制备水煤气时,适当加快通入水蒸气流速,有利于水煤气生成
C.体系温度升高,可能导致催化剂失活,用热交换器将原料气可预热并使反应体系冷却
D.终端出口2得到的气体,通过液化可分离出
(4)LiH-3d过渡金属复合催化剂也可用于催化合成氨,已知
 先被吸附发生反应
先被吸附发生反应
 ,紧接着
,紧接着 被吸附发生的反应方程式
被吸附发生的反应方程式
您最近一年使用:0次
3 . 近年碳中和理念成为热门,通过“CO2→合成气→高附加值产品”的工艺路
线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①

②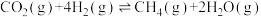

则

_______ 
(2)CO2经催化加氢可合成烯烃: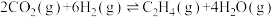
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是_____ (填字母)。
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为_______ (用化学式表示)。
(3)由CO2与H2反应合成甲醇:
 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
该条件下的分压平衡常数 Kp= ______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加_____ g。

线,可有效实现 CO2的资源化利用。请回答下列问题:
(1)CO2 加氢制合成气(CO、H2)时发生下列反应:
已知:①


②
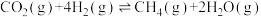

则



(2)CO2经催化加氢可合成烯烃:
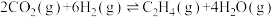
 。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
。在 0.1MPa时,按 n(CO2)∶n(H2)=1∶3 投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
①在一个恒温恒容的密闭容器中,该可逆反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.2v 正(CO2)=3v 逆(H2)
C.容器内压强不随时间变化 D.混合气体的密度不再改变
② 曲线 c 表示的物质为
(3)由CO2与H2反应合成甲醇:

 。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
。某温度下将1mol CO2和3molH2充入体积不变的 2L 密闭容器中,初始总压为 8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
| p后/p前 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
(4)电催化 CO2 制备燃料可实现资源综合利用。如图所示装置工作时,阴极只生成 HCOOH 时,每转移 2mol 电子,阴极室溶液质量增加

您最近一年使用:0次
解题方法
4 .  可作为制备甲烷、甲醇和甲醛等的原料,对于实现“碳中和”具有重要的意义。回答下列问题:
可作为制备甲烷、甲醇和甲醛等的原料,对于实现“碳中和”具有重要的意义。回答下列问题:
(1)已知下列反应;
Ⅰ.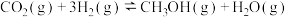
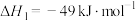
Ⅱ.
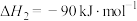
①反应Ⅲ的平衡常数表达式为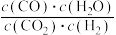 ,则反应Ⅲ的热化学方程式为
,则反应Ⅲ的热化学方程式为________ ,该反应中的活化能 (正)
(正) ________ (填“>”或“<”) (逆)。
(逆)。
②在恒容条件下进行反应Ⅱ,下列情况能说明该反应一定达平衡的是________ (填字母)。
A. B.气体的密度不再随时间改变
B.气体的密度不再随时间改变
C.CO的体积分数不再随时间改变 D.气体的平均摩尔质量不再随时间改变
③某温度下,在体积为2L的恒容密闭容器中加入6mol 、2mol
、2mol  进行反应Ⅰ,若平衡时容器内的压强与起始压强之比为4:5.达到平衡时
进行反应Ⅰ,若平衡时容器内的压强与起始压强之比为4:5.达到平衡时 的转化率是
的转化率是________ ,此温下,该反应的平衡常数为________ (列出计算式即可)。
(2)研究表明,可以将 转化为炭黑回收利用,反应原理如图所示。
转化为炭黑回收利用,反应原理如图所示。
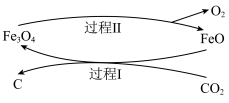
①整个过程中FeO的作用是___________ 。
② 转化为炭黑的总反应化学方程式为
转化为炭黑的总反应化学方程式为___________ 。
(3)工业上常用高浓度的 溶液吸收
溶液吸收 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:

①在阳极区发生的反应包括___________ 和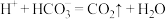
②简述 在阴极区再生的原理:
在阴极区再生的原理:______________________ 。
 可作为制备甲烷、甲醇和甲醛等的原料,对于实现“碳中和”具有重要的意义。回答下列问题:
可作为制备甲烷、甲醇和甲醛等的原料,对于实现“碳中和”具有重要的意义。回答下列问题:(1)已知下列反应;
Ⅰ.
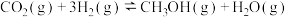
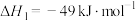
Ⅱ.

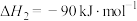
①反应Ⅲ的平衡常数表达式为
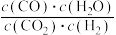 ,则反应Ⅲ的热化学方程式为
,则反应Ⅲ的热化学方程式为 (正)
(正)  (逆)。
(逆)。②在恒容条件下进行反应Ⅱ,下列情况能说明该反应一定达平衡的是
A.
 B.气体的密度不再随时间改变
B.气体的密度不再随时间改变C.CO的体积分数不再随时间改变 D.气体的平均摩尔质量不再随时间改变
③某温度下,在体积为2L的恒容密闭容器中加入6mol
 、2mol
、2mol  进行反应Ⅰ,若平衡时容器内的压强与起始压强之比为4:5.达到平衡时
进行反应Ⅰ,若平衡时容器内的压强与起始压强之比为4:5.达到平衡时 的转化率是
的转化率是(2)研究表明,可以将
 转化为炭黑回收利用,反应原理如图所示。
转化为炭黑回收利用,反应原理如图所示。
①整个过程中FeO的作用是
②
 转化为炭黑的总反应化学方程式为
转化为炭黑的总反应化学方程式为(3)工业上常用高浓度的
 溶液吸收
溶液吸收 ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
①在阳极区发生的反应包括
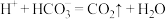
②简述
 在阴极区再生的原理:
在阴极区再生的原理:
您最近一年使用:0次
2023-06-12更新
|
57次组卷
|
3卷引用:陕西省汉中市镇巴县2022-2023学年高二下学期期末考试化学试题
5 . Ⅰ.制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为____________________ ;
②下列能提高碳的平衡转化率的措施是____________________ 。
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
________________________________________________________________ 。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
________________________________________________________________ 。
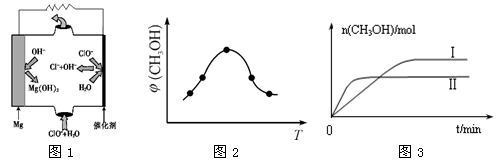
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:_____________________________________________________________ 。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH__________ (填“>” “<”或“=”)0。
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ__________________ KⅡ(填“>” “<”或“=”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________________ 。
 CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为
②下列能提高碳的平衡转化率的措施是
| A.加入C(s) |
| B.加入H2O(g) |
| C.升高温度 |
| D.增大压强 |
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:

(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)
 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H ①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为
您最近一年使用:0次
2016-12-08更新
|
178次组卷
|
2卷引用:2015届陕西省西安市长安一中高三上学期第三次月考化学试卷



