名校
解题方法
1 . 为实现“碳中和”“碳达峰”,碳的循环利用是重要措施。利用氢气和CO反应生成甲烷,涉及的反应如下:
i.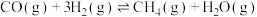

ii.

iii.

回答下列问题:
(1)在25℃和101kPa下, 转变为
转变为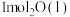 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
________  。
。
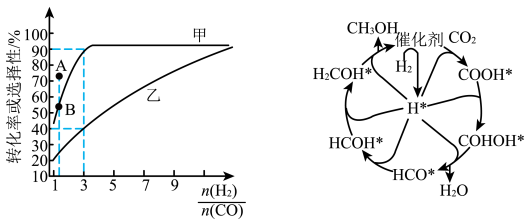
(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。 选择性变化的曲线是
选择性变化的曲线是________ (填“甲”或“乙”),保持 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为________ 。
②相同温度下,向恒容容器内加入 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为________ mol,反应ii的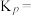
________ (保留小数点后一位)。
(3) 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共________ 种, 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为________ 。
i.
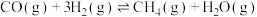

ii.


iii.


回答下列问题:
(1)在25℃和101kPa下,
 转变为
转变为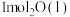 时放出44.0kJ热量,
时放出44.0kJ热量, 的燃烧热为
的燃烧热为 ,CO的燃烧热为
,CO的燃烧热为 ,
, 的燃烧热为
的燃烧热为 ,则
,则
 。
。(2)一定温度下,在恒容的密闭容器中进行上述反应,平衡时CO的转化率及
 的选择性随
的选择性随 变化的情况如图所示[已知
变化的情况如图所示[已知 的选择性
的选择性 ]。
]。
 选择性变化的曲线是
选择性变化的曲线是 不变,曲线甲由B点达到A点需要的条件为
不变,曲线甲由B点达到A点需要的条件为②相同温度下,向恒容容器内加入
 和1molCO,初始压强为10MPa,平衡时
和1molCO,初始压强为10MPa,平衡时 的物质的量为
的物质的量为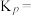
(3)
 催化加氢制甲醇也是碳循环的重要途径。
催化加氢制甲醇也是碳循环的重要途径。 在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共
在某催化剂表面与氢气作用制备甲醇的反应机理如图所示。催化循环中产生的中间体微粒共 催化加氢制甲醇总反应的化学方程式为
催化加氢制甲醇总反应的化学方程式为
您最近一年使用:0次
7日内更新
|
216次组卷
|
7卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
解题方法
2 . 石油化工生产过程中,将石油分馏产物中长链烃的裂解产物进行分离,就可以得到合成纤维工业、塑料工业、橡胶工业等重要的短链烃化工原料。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。___________ 。
(2)已知: 、
、 、
、 的键能分别为:
的键能分别为: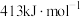 、
、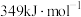 、
、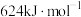 。
。
反应1: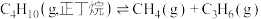

反应2: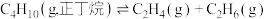

①裂解反应1在___________ (填“高温”、“低温”或“任何温度”)下能自发进行;
②裂解反应2的正反应活化能___________ (填“ ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率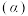 与压强
与压强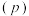 和温度
和温度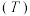 的关系如图2所示。
的关系如图2所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是___________ 。
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。
①0~6min内,利用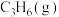 表示的平均反应速率为
表示的平均反应速率为___________  。
。
②7min时改变的条件可能是___________ (填字母)。
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数
___________ MPa。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。

(2)已知:
 、
、 、
、 的键能分别为:
的键能分别为: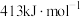 、
、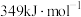 、
、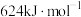 。
。反应1:
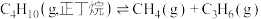

反应2:
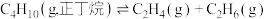

①裂解反应1在
②裂解反应2的正反应活化能
 ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率
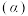 与压强
与压强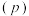 和温度
和温度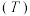 的关系如图2所示。
的关系如图2所示。
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。

①0~6min内,利用
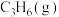 表示的平均反应速率为
表示的平均反应速率为 。
。②7min时改变的条件可能是
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数

您最近一年使用:0次
解题方法
3 . 将 转化为
转化为 等燃料有助于降低大气中
等燃料有助于降低大气中 浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
(1)已知下列反应的热化学方程式:
Ⅰ.2CO2(g)+2H2O(g)⇌2C2H4(g)+3O2(g) K1 ΔH1=+1323kJ/mol
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) K2 ΔH2=+41kJ/mol
Ⅲ.C2H4(g)+H2O(g)⇌C2H5OH(g) K3 ΔH3=-45.5kJ/mol
反应2CO(g)+5H2O(g)⇌2C2H5OH(g)+3O2(g)+2H2(g)的
___________ ,平衡常数K=___________ (用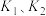 和
和 表示)。
表示)。
(2)将5mol 和20mol
和20mol 通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。
通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是___________ (填“低”或“高”,后同)温___________ 压。
②800K时,反应Ⅱ的平衡常数
___________ (用平衡分压代替物质的量浓度计算,保留两位有效数字)。
③500K时,若只发生反应Ⅳ,下列说法能判断反应达到平衡状态的是___________ (填标号)。
A.消耗1mol 的同时生成2mol
的同时生成2mol
B.混合气体的平均相对分子质量保持不变
C. 的体积分数不再变化
的体积分数不再变化
D.体系的温度不再发生变化
(3)我国科学家提出了一种用双催化剂协同催化 合成
合成 的路径。先利用催化剂将
的路径。先利用催化剂将 转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成
转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成 ,该过程能量与反应进程的关系如图2所示。
,该过程能量与反应进程的关系如图2所示。___________ (用“→”表示含碳物质间的转化)。
②游离态CO的自由能___________ (填“大于”或“小于”) *CO的自由能。
 转化为
转化为 等燃料有助于降低大气中
等燃料有助于降低大气中 浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。
浓度,还能获得乙醇等高附加值化学品,是实现“碳中和”目标的一种有效途径。(1)已知下列反应的热化学方程式:
Ⅰ.2CO2(g)+2H2O(g)⇌2C2H4(g)+3O2(g) K1 ΔH1=+1323kJ/mol
Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) K2 ΔH2=+41kJ/mol
Ⅲ.C2H4(g)+H2O(g)⇌C2H5OH(g) K3 ΔH3=-45.5kJ/mol
反应2CO(g)+5H2O(g)⇌2C2H5OH(g)+3O2(g)+2H2(g)的

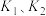 和
和 表示)。
表示)。(2)将5mol
 和20mol
和20mol 通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。
通入起始压强为p的某恒容密闭容器中发生反应Ⅳ:CO2(g)+4H2(g)⇌CH4(g)+2H2O(g) K4 ΔH4=-165kJ/mol(主反应)和反应Ⅱ(副反应),平衡时容器中含碳物质的物质的量随温度的变化如图1所示。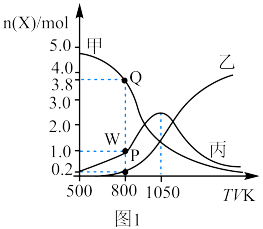
 的产率,理论上应采用的措施是
的产率,理论上应采用的措施是②800K时,反应Ⅱ的平衡常数

③500K时,若只发生反应Ⅳ,下列说法能判断反应达到平衡状态的是
A.消耗1mol
 的同时生成2mol
的同时生成2mol
B.混合气体的平均相对分子质量保持不变
C.
 的体积分数不再变化
的体积分数不再变化D.体系的温度不再发生变化
(3)我国科学家提出了一种用双催化剂协同催化
 合成
合成 的路径。先利用催化剂将
的路径。先利用催化剂将 转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成
转化为*CO(*表示吸附态)和游离态的CO,再经过一系列的反应形成 ,该过程能量与反应进程的关系如图2所示。
,该过程能量与反应进程的关系如图2所示。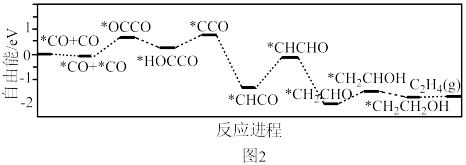
②游离态CO的自由能
您最近一年使用:0次
解题方法
4 . 二氧化碳催化加氢制甲烷的反应受到人们广泛关注。回答下列问题:
(1)二氧化碳加氢制甲烷的过程中主要发生以下反应:
Ⅰ.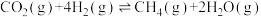
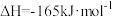
Ⅱ.

反应 的
的
_______  ,该反应在
,该反应在_______ (填“低温”“高温”或“任意温度”)条件下能自发进行。
(2)以Ni作催化剂,可选择 、
、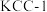 、
、 为载体。在密闭容器中,控制
为载体。在密闭容器中,控制 、加入
、加入 和
和 ,使用不同的催化剂载体,发生反应Ⅰ、Ⅱ,
,使用不同的催化剂载体,发生反应Ⅰ、Ⅱ, 的转化率及其平衡转化率随温度变化的情况如图所示。
的转化率及其平衡转化率随温度变化的情况如图所示。_______ 。
②在图中所示温度范围内,随温度升高, 的平衡转化率减小,原因可能是
的平衡转化率减小,原因可能是_______ 。研究表明,当温度升至600℃以上, 的平衡转化率随温度升高而增大,此时
的平衡转化率随温度升高而增大,此时 的产率随温度升高而
的产率随温度升高而_______ (填“升高”“降低”或“不变”)。
③525℃下达到平衡时, 的转化率为80%,
的转化率为80%, 的转化率为57.5%,
的转化率为57.5%, 的物质的量为
的物质的量为_______ mol,反应Ⅰ用摩尔分数表示的平衡常数
_______ (列出计算式,用摩尔分数代替平衡浓度计算,物质i的摩尔分数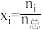 )。
)。
(3)若反应物中混入 ,会导致Ni催化剂失活。原因是
,会导致Ni催化剂失活。原因是 吸附在Ni活性位点,阻止了
吸附在Ni活性位点,阻止了 与
与 的反应。在Ni催化剂中添加Mn和Zn助剂,可避免Ni催化剂失活,其机理可能是
的反应。在Ni催化剂中添加Mn和Zn助剂,可避免Ni催化剂失活,其机理可能是_______ 。
(1)二氧化碳加氢制甲烷的过程中主要发生以下反应:
Ⅰ.
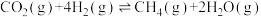
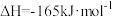
Ⅱ.


反应
 的
的
 ,该反应在
,该反应在(2)以Ni作催化剂,可选择
 、
、 、
、 为载体。在密闭容器中,控制
为载体。在密闭容器中,控制 、加入
、加入 和
和 ,使用不同的催化剂载体,发生反应Ⅰ、Ⅱ,
,使用不同的催化剂载体,发生反应Ⅰ、Ⅱ, 的转化率及其平衡转化率随温度变化的情况如图所示。
的转化率及其平衡转化率随温度变化的情况如图所示。
②在图中所示温度范围内,随温度升高,
 的平衡转化率减小,原因可能是
的平衡转化率减小,原因可能是 的平衡转化率随温度升高而增大,此时
的平衡转化率随温度升高而增大,此时 的产率随温度升高而
的产率随温度升高而③525℃下达到平衡时,
 的转化率为80%,
的转化率为80%, 的转化率为57.5%,
的转化率为57.5%, 的物质的量为
的物质的量为
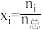 )。
)。(3)若反应物中混入
 ,会导致Ni催化剂失活。原因是
,会导致Ni催化剂失活。原因是 吸附在Ni活性位点,阻止了
吸附在Ni活性位点,阻止了 与
与 的反应。在Ni催化剂中添加Mn和Zn助剂,可避免Ni催化剂失活,其机理可能是
的反应。在Ni催化剂中添加Mn和Zn助剂,可避免Ni催化剂失活,其机理可能是
您最近一年使用:0次
解题方法
5 .  和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
Ⅰ.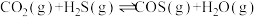
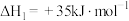
Ⅱ.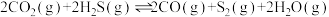
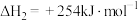
Ⅲ.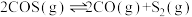

回答下列问题:
(1)反应Ⅲ的反应热
________ ,该反应在________ (填“高温”“低温”或“任意温度”)下能自发进行;
(2)向某密闭容器中投入等物质的量的 和
和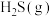 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;________ ,原因为________ ;
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是________ (填字母);
A. 和
和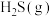 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
B. 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时
C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3) 下,向起始压强为
下,向起始压强为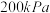 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和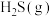 混合气体,发生上述反应,
混合气体,发生上述反应,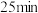 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为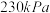 ,
, ;
;
①平衡时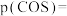
________ 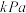 ;
;
② 的平均生成速率为
的平均生成速率为________  ;
;
③ 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
________  ;
;
 和
和 共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:
共活化处理的研究既有利于实现碳中和,又有利于处理某些环境中的有害气体.该研究过程主要涉及如下反应:Ⅰ.
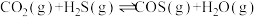
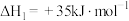
Ⅱ.
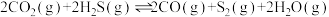
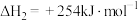
Ⅲ.
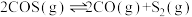

回答下列问题:
(1)反应Ⅲ的反应热

(2)向某密闭容器中投入等物质的量的
 和
和 ,发生上述反应.其中
,发生上述反应.其中 的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;
的平衡转化率随温度或压强变化如图.L,X可分别代表压强或温度;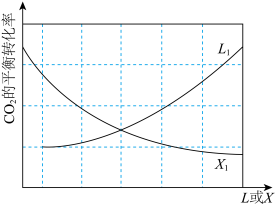
②若在恒温恒容密闭容器中发生上述反应,下列条件能说明上述反应均达到平衡状态的是
A.
 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时B.
 和
和 的物质的量之比不再发生变化时
的物质的量之比不再发生变化时C. 混合气体密度不再发生变化时
D. 容器内压强不再发生变化时
(3)
 下,向起始压强为
下,向起始压强为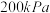 的恒容密闭容器中通入等物质的量的
的恒容密闭容器中通入等物质的量的 和
和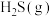 混合气体,发生上述反应,
混合气体,发生上述反应,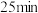 时达到平衡状态,测得此时体系总压强为
时达到平衡状态,测得此时体系总压强为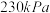 ,
, ;
;①平衡时
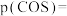
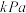 ;
;②
 的平均生成速率为
的平均生成速率为 ;
;③
 下反应Ⅲ的压力平衡常数
下反应Ⅲ的压力平衡常数
 ;
;
您最近一年使用:0次
解题方法
6 . 二甲醚 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
 .
.

 .
.

 .
.

回答下列问题:
(1)
___________ 。
(2)向初始温度为T℃的某恒容绝热容器中投入2mol 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。
①下列叙述能说明反应 已经达到平衡的是
已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
d. 的体积分数不再发生变化
的体积分数不再发生变化
②相同条件下,若向该容器中加入 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
___________ 1(填“>”“=”或“<”)。
③在催化剂条件下反应 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为___________ (填“第一步”或“第二步”),判断的理由是___________ 。
(3)向压强恒定为p kPa的某密闭容器中按 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示 随温度变化的曲线是
随温度变化的曲线是___________ (填“ ”或“
”或“ ”),原因为
”),原因为___________ 。
② K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字); K时反应
K时反应 的压强平衡常数
的压强平衡常数
___________  (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下: .
.

 .
.

 .
.

回答下列问题:
(1)

(2)向初始温度为T℃的某恒容绝热容器中投入2mol
 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。①下列叙述能说明反应
 已经达到平衡的是
已经达到平衡的是a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率d.
 的体积分数不再发生变化
的体积分数不再发生变化②相同条件下,若向该容器中加入
 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
③在催化剂条件下反应
 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为
(3)向压强恒定为p kPa的某密闭容器中按
 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示
 随温度变化的曲线是
随温度变化的曲线是 ”或“
”或“ ”),原因为
”),原因为②
 K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为 K时反应
K时反应 的压强平衡常数
的压强平衡常数
 (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
您最近一年使用:0次
2024-05-19更新
|
206次组卷
|
4卷引用:2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学
2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
7 . 我国力争于2030年前实现碳达峰,2060年前实现碳中和,因此 的综合利用成为研究热点。
的综合利用成为研究热点。
(1)通过捕捉空气中的 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
_______  。
。
(2)利用电喷雾电离等方法可得 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: 与
与 反应的能量变化曲线为
反应的能量变化曲线为_______ (填“c”或“d”),写出 与
与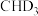 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:_______ 或_______ 。
(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:
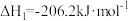
反应Ⅱ:
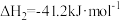
反应皿: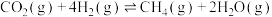
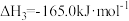
T℃时,向恒容密闭容器中充入一定量的 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率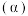 及
及 和
和 的物质的量
的物质的量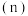 随
随 变化的情况如图所示。
变化的情况如图所示。 变化的曲线是
变化的曲线是_______ (填“a”、“b”、“c”或“d”);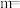
_______ ; 的选择性
的选择性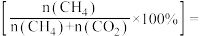
_______ 。
②已知起始充入1mol 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
_______ (用含 的代数式表示)。
的代数式表示)。
 的综合利用成为研究热点。
的综合利用成为研究热点。(1)通过捕捉空气中的
 和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286
和电解水产生的H2可以合成“零碳甲醇”。已知H2(g)的燃烧热为286 ,
, 的燃烧热为726
的燃烧热为726 ,反应
,反应 的
的
 。
。(2)利用电喷雾电离等方法可得
 ,
, 与
与 反应能高选择性地生成甲醇,反应机理如下图所示:
反应能高选择性地生成甲醇,反应机理如下图所示: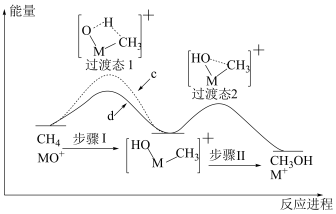
 与
与 反应的能量变化曲线为
反应的能量变化曲线为 与
与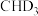 反应生成的氘代甲醇的结构简式:
反应生成的氘代甲醇的结构简式:(3)氢气和碳氧化物反应生成甲烷,涉及反应如下:
反应Ⅰ:

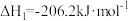
反应Ⅱ:

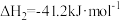
反应皿:
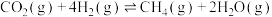
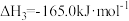
T℃时,向恒容密闭容器中充入一定量的
 和1mol
和1mol  ,平衡时
,平衡时 和CO的转化率
和CO的转化率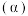 及
及 和
和 的物质的量
的物质的量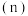 随
随 变化的情况如图所示。
变化的情况如图所示。
 变化的曲线是
变化的曲线是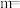
 的选择性
的选择性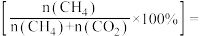
②已知起始充入1mol
 和1mol
和1mol 进行上述反应时,起始压强为
进行上述反应时,起始压强为 。反应Ⅰ的分压平衡常数
。反应Ⅰ的分压平衡常数
 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-29更新
|
136次组卷
|
2卷引用:2024届陕西省铜川市高三下学期第三次模拟考试理科综合试题-高中化学
8 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)已知: 、
、 和
和 键的键能分别为
键的键能分别为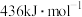 、
、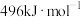 和
和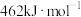 。
。

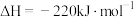

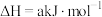
则
___________ 。
(2)已知: 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。___________ (填I或II)时,反应过程中 所能达到的最高浓度更大。
所能达到的最高浓度更大。
②在相同条件下反应达到平衡状态,为提高 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是___________ 。
(3)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.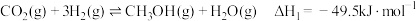
II.
在密闭容器中,压强恒为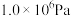 ,
,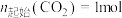 ,
,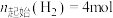 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。 的选择性可表示为
的选择性可表示为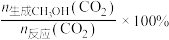 。
。
①反应的最佳温度___________ 。
②反应温度超过 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是___________ 。
③反应温度超过 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是___________ 。
④反应温度在 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时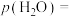
___________  (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数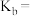
___________ 。
(4)工业废气中含有的 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。___________ 。
②装置b中,x和y为石墨电极,写出电极x的电极反应___________ 。
(1)已知:
 、
、 和
和 键的键能分别为
键的键能分别为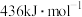 、
、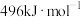 和
和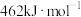 。
。
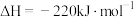

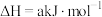
则

(2)已知:
 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。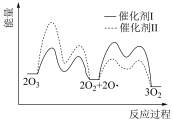
 所能达到的最高浓度更大。
所能达到的最高浓度更大。②在相同条件下反应达到平衡状态,为提高
 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是(3)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
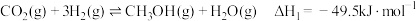
II.

在密闭容器中,压强恒为
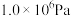 ,
,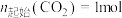 ,
,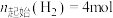 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。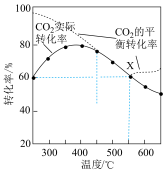
 的选择性可表示为
的选择性可表示为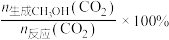 。
。①反应的最佳温度
②反应温度超过
 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是③反应温度超过
 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是④反应温度在
 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时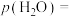
 (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数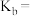
(4)工业废气中含有的
 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。
②装置b中,x和y为石墨电极,写出电极x的电极反应
您最近一年使用:0次
解题方法
9 .  作为碳源加氢是能源再生的有效方法,利用
作为碳源加氢是能源再生的有效方法,利用 加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
(1)已知反应Ⅰ:

反应Ⅱ:
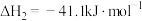
反应Ⅲ:

 的燃烧热
的燃烧热 分别为
分别为 。
。
①
_____  ,反应①的活化能
,反应①的活化能 (正)
(正)_____ (填“大于”“小于”或“等于”) (逆)。
(逆)。
②若 分别表示反应Ⅰ、反应Ⅱ的平衡常数,则
分别表示反应Ⅰ、反应Ⅱ的平衡常数,则 的平衡常数
的平衡常数
_____ (用含 的代数式表示)。
的代数式表示)。
(2)在催化剂作用下,发生上述反应Ⅰ、反应Ⅱ,达到平衡时 的转化率随温度和压强的变化如图,
的转化率随温度和压强的变化如图,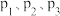 由大到小的顺序为 ;压强一定时,
由大到小的顺序为 ;压强一定时, 的平衡转化率呈现如图变化趋势的原因为
的平衡转化率呈现如图变化趋势的原因为_____ 。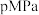 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入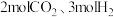 ,发生反应Ⅰ、反应Ⅱ,反应经
,发生反应Ⅰ、反应Ⅱ,反应经 达到平衡,平衡时
达到平衡,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 。
。
①用单位时间内氢气的压强变化表示的反应速率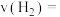
_____ MPa∙min-1。
②反应Ⅱ的平衡常数
_____  。
。
 作为碳源加氢是能源再生的有效方法,利用
作为碳源加氢是能源再生的有效方法,利用 加氢生产甲醇是有前景的可再生路线之一、回答下列问题:
加氢生产甲醇是有前景的可再生路线之一、回答下列问题:(1)已知反应Ⅰ:


反应Ⅱ:

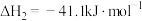
反应Ⅲ:


 的燃烧热
的燃烧热 分别为
分别为 。
。①

 ,反应①的活化能
,反应①的活化能 (正)
(正) (逆)。
(逆)。②若
 分别表示反应Ⅰ、反应Ⅱ的平衡常数,则
分别表示反应Ⅰ、反应Ⅱ的平衡常数,则 的平衡常数
的平衡常数
 的代数式表示)。
的代数式表示)。(2)在催化剂作用下,发生上述反应Ⅰ、反应Ⅱ,达到平衡时
 的转化率随温度和压强的变化如图,
的转化率随温度和压强的变化如图,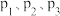 由大到小的顺序为 ;压强一定时,
由大到小的顺序为 ;压强一定时, 的平衡转化率呈现如图变化趋势的原因为
的平衡转化率呈现如图变化趋势的原因为
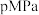 ,向容积为
,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入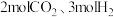 ,发生反应Ⅰ、反应Ⅱ,反应经
,发生反应Ⅰ、反应Ⅱ,反应经 达到平衡,平衡时
达到平衡,平衡时 的转化率是
的转化率是 ,体系内剩余
,体系内剩余 。
。①用单位时间内氢气的压强变化表示的反应速率
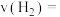
②反应Ⅱ的平衡常数

 。
。
您最近一年使用:0次
解题方法
10 . 氮及其化合物与人们的生活生产密切相关。回答下列问题:
(1)微生物作用下,废水中的NH 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:
Ⅰ步:2 NH (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
Ⅱ步:2NO (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。
则低浓度氨氮废水中的NH (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=___________ kJ/mol。
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g) 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
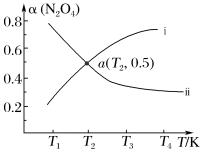
α(N2O4)随温度的变化的正确曲线是___________ (填“i”或“ii”)。若该容器中通入N2O4的起始浓度为2mol/L,则a点温度下的平衡常数K=___________ 。若加入催化剂,图中的曲线会___________ (填“上移”、“下移”或“不移”)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
则反应温度高的容器是___________ (填“甲”或“乙”);甲容器中,0~120 min的速率v(N2)=___________ mol/(L·min),达到化学平衡后,乙容器中各物质均加倍,则平衡向___________ (“正反应”或“逆反应”)方向移动。
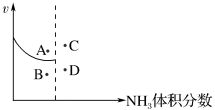
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为___________ (从点“A、B、C、D”中选择)。
(1)微生物作用下,废水中的NH
 可转化为NO
可转化为NO ,该反应分两步反应:
,该反应分两步反应:Ⅰ步:2 NH
 (aq)+3O2(g)=2NO
(aq)+3O2(g)=2NO (aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/mol
(aq)+4H+(aq)+2H2O(l) ΔH=-546 kJ/molⅡ步:2NO
 (aq)+O2(g)=2NO
(aq)+O2(g)=2NO (aq) ΔH=-146 kJ/mol。
(aq) ΔH=-146 kJ/mol。则低浓度氨氮废水中的NH
 (aq)氧化生成NO
(aq)氧化生成NO (aq)的热化学方程式为:NH
(aq)的热化学方程式为:NH (aq)+2O2(g)=2H+(aq)+H2 O(l)+NO
(aq)+2O2(g)=2H+(aq)+H2 O(l)+NO (aq) ΔH=
(aq) ΔH=(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
已知可逆反应N2O4(g)
 2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) ΔH>0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) ΔH<0。已知甲、乙两个恒温恒容容器,容积均为1 L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:| t/min | 0 | 40 | 80 | 120 | 160 |
| n甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
(4)500 ℃时,恒容密闭容器中通入1 mol N2和3 mol H2,模拟合成氨的反应,已知该反应放热,且随着反应的进行合成氨的正反应速率与NH3的体积分数的关系如下图所示,若升高温度再次达到平衡时,可能的点为

您最近一年使用:0次



