解题方法
1 . 如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是

| A.热稳定性:MgF2<MgCl2<MgBr2<MgI2 |
| B.22.4L F2(g)与足量的Mg充分反应,放热1124kJ |
| C.由图可知:MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l) ΔH<-117kJ/mol |
| D.工业上可由电解MgCl2溶液冶炼金属Mg,该过程需要吸收热量 |
您最近一年使用:0次
解题方法
2 . 下列说法不正确的是
| A.化学反应中一定伴随能量变化 |
| B.S 在纯氧中燃烧是将全部化学能转化为热能 |
| C.石墨转换成金刚石为吸热反应,故石墨的稳定性大于金刚石 |
| D.化学反应的∆H,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
名校
3 . NO催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
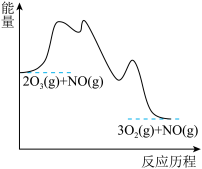
第1步: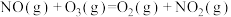
 ;
;
第2步: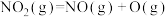
 ;
;
第3步: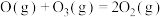
 。下列说法正确的是
。下列说法正确的是
 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
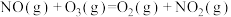
 ;
;第2步:
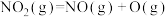
 ;
;第3步:
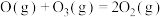
 。下列说法正确的是
。下列说法正确的是| A.三步基元反应都是放热反应 |
| B.第2步是总反应的决速步 |
| C.该过程共有三种中间产物 |
D.总反应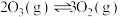 的焓变为 的焓变为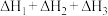 |
您最近一年使用:0次
2024-01-08更新
|
148次组卷
|
2卷引用:湖南省张家界市民族中学2023-2024学年高二上学期第一次月考化学试题
4 . 已知:①
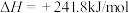
②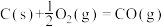
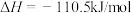
③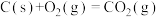
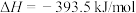
下列说法错误的是

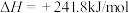
②
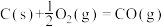
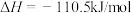
③
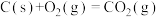
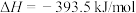
下列说法错误的是
| A.上述反应中属于吸热反应的只有反应① |
| B.H2的燃烧热为241.8kJ/mol |
| C.CO的燃烧热为283kJ/mol |
D. 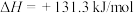 |
您最近一年使用:0次
2023-11-09更新
|
262次组卷
|
4卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 中国科学家为实现“碳中和”目标而不断努力,以 为原料合成甲烷、乙醇等能源物质具有良好的发展前景。
为原料合成甲烷、乙醇等能源物质具有良好的发展前景。
(1) 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:
主反应:

副反应:

①已知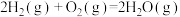
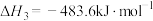 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式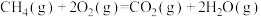

__________ 。
②500℃时,向1L恒容密闭容器中充入 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为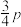 ,则0~20min内,
,则0~20min内,
__________  ,主反应的平衡常数
,主反应的平衡常数
__________ (保留3位有效数字,下同),平衡时 选择性=
选择性=__________ ( )。
)。
(2)已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为:

 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。

图1 图2 图3
①图1中投料比相同,温度从高到低的顺序为__________ 。
②图2中 、
、 、
、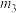 从大到小的顺序为
从大到小的顺序为__________ 。
③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。
则该反应的活化能
__________ 。当改变外界条件时,实验数据如图3中的曲线b所示,则实验可能改变的外界条件是______________________________ 。
 为原料合成甲烷、乙醇等能源物质具有良好的发展前景。
为原料合成甲烷、乙醇等能源物质具有良好的发展前景。(1)
 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
在固体催化表面加氢合成甲烷过程中发生以下两个反应:主反应:


副反应:


①已知
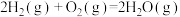
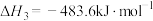 ,则
,则 燃烧的热化学方程式
燃烧的热化学方程式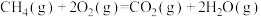

②500℃时,向1L恒容密闭容器中充入
 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为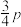 ,则0~20min内,
,则0~20min内,
 ,主反应的平衡常数
,主反应的平衡常数
 选择性=
选择性= )。
)。(2)已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为:
 ,设m为起始时的投料比,即
,设m为起始时的投料比,即 。
。
图1 图2 图3
①图1中投料比相同,温度从高到低的顺序为
②图2中
 、
、 、
、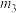 从大到小的顺序为
从大到小的顺序为③该反应的Arrhenius经验公式的实验数据如图3中曲线a所示,已知Arhenius经验公式
 (
( 为活化能,k为速率常数,R和C为常数)。
为活化能,k为速率常数,R和C为常数)。则该反应的活化能

您最近一年使用:0次
名校
6 . 天然气的主要成分甲烷是一种重要的化工原料,广泛应用于民用和化工生产中。试回答下列问题:
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g) + H2O(g)= CO(g) + 3H2(g) ΔH1= +196 kJ·mol−1
②2H2(g) + O2(g)= 2H2O(g) ΔH2= −484 kJ·mol−1
③2CO(g) + O2(g)=2CO2(g) ΔH3= −566 kJ·mol−1
则CH4(g) + CO2(g)= 2CO(g) + 2H2(g) ΔH=___________
(2)在两个相同刚性密闭容器中充入CH4和CO2发生反应:CH4(g) + CO2(g) 2CO(g) + 2H2(g),CH4和CO2的分压均为20 KPa,加入催化剂Ni/α−Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图所示。
2CO(g) + 2H2(g),CH4和CO2的分压均为20 KPa,加入催化剂Ni/α−Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图所示。___________ B点处v逆(填“<”、“>”或“=”)。
②T2℃下,该反应用分压表示的平衡常数Kp=___________ kPa2(结果保留到小数点后一位)
③下列说法不能表明该反应已达平衡状态的是___________
A.一定温度下,恒容密闭容器中按2:1的物质的量之比通入CH4(g)和CO2(g),二者转化率之比保持不变
B.每断裂2 mol C−H键的同时形成1mol H−H键
C.恒温恒压密闭容器中,混合气体的密度保持不变
D.恒温恒容密闭容器中,混合气体的平均相对分子质量保持不变
④上述反应达到平衡后,下列变化一定能使平衡向正向移动的是___________
A.恒容通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图所示。三种催化剂作用下,反应活化能最大的是___________ (填“甲”、“乙”或“丙”);850℃条件下三条曲线交于一点最可能的原因是___________ 。
(1)利用CH4超干重整CO2技术可得到富含CO的化工原料。
已知:①CH4(g) + H2O(g)= CO(g) + 3H2(g) ΔH1= +196 kJ·mol−1
②2H2(g) + O2(g)= 2H2O(g) ΔH2= −484 kJ·mol−1
③2CO(g) + O2(g)=2CO2(g) ΔH3= −566 kJ·mol−1
则CH4(g) + CO2(g)= 2CO(g) + 2H2(g) ΔH=
(2)在两个相同刚性密闭容器中充入CH4和CO2发生反应:CH4(g) + CO2(g)
 2CO(g) + 2H2(g),CH4和CO2的分压均为20 KPa,加入催化剂Ni/α−Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图所示。
2CO(g) + 2H2(g),CH4和CO2的分压均为20 KPa,加入催化剂Ni/α−Al2O3,分别在T1℃和T2℃下进行反应,测得CH4转化率随时间变化如图所示。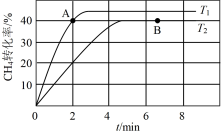
②T2℃下,该反应用分压表示的平衡常数Kp=
③下列说法不能表明该反应已达平衡状态的是
A.一定温度下,恒容密闭容器中按2:1的物质的量之比通入CH4(g)和CO2(g),二者转化率之比保持不变
B.每断裂2 mol C−H键的同时形成1mol H−H键
C.恒温恒压密闭容器中,混合气体的密度保持不变
D.恒温恒容密闭容器中,混合气体的平均相对分子质量保持不变
④上述反应达到平衡后,下列变化一定能使平衡向正向移动的是
A.恒容通入惰性气体使容器内压强增大 B.正反应速率加快
C.平衡常数K变大 D.增大催化剂表面积
(3)其他条件相同,在甲、乙、丙三种不同催化剂作用下,相同时间内测得甲烷转化率随温度变化如图所示。三种催化剂作用下,反应活化能最大的是
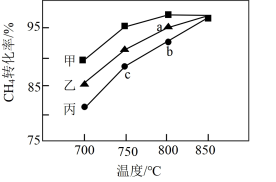
您最近一年使用:0次
2023-10-24更新
|
336次组卷
|
4卷引用:湖南省长沙市实验中学2023-2024学年高二上学期期中考试化学试题
7 . 化学反应所提供的能量大大促进了社会的发展,研究化学反应中的能量变化有重要意义,回答下列问题:
(1)生活中常见燃料的燃烧热如下表所示:
①写出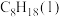 燃烧热的热化学方程式:
燃烧热的热化学方程式:___________ 。
②“热值”指单位质量的燃料完全燃烧放出的热量,则 的热值为
的热值为___________ kJ/kg。
③已知:
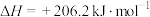

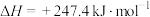
则 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为___________ 。
④碱性氢气燃料电池可大大提高氢气的能量利用率,请写出该燃料电池负极的电极反应式:___________ 。该燃料电池转移2 mol电子时,实际提供的电能为200.06 kJ,则该电池的能量转化率为___________ %(保留整数)。
(2)火箭推进剂常用液态过氧化氢作氧化剂,液态肼( )作还原剂,二者混合即可剧烈反应生成氮气和水,若0.5 mol肼完全被氧化放出408.8 kJ的热量。则6.4 g液态肼完全被氧化转移电子的数目为
)作还原剂,二者混合即可剧烈反应生成氮气和水,若0.5 mol肼完全被氧化放出408.8 kJ的热量。则6.4 g液态肼完全被氧化转移电子的数目为___________  ,放出的热量为
,放出的热量为___________ kJ(保留两位小数)。
(1)生活中常见燃料的燃烧热如下表所示:
| 燃料 |  | CO |  | 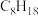 |
燃烧热/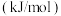 | 285.8 | 283.0 | 890.3 | 5518 |
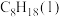 燃烧热的热化学方程式:
燃烧热的热化学方程式:②“热值”指单位质量的燃料完全燃烧放出的热量,则
 的热值为
的热值为③已知:

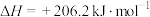

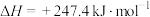
则
 与
与 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为④碱性氢气燃料电池可大大提高氢气的能量利用率,请写出该燃料电池负极的电极反应式:
(2)火箭推进剂常用液态过氧化氢作氧化剂,液态肼(
 )作还原剂,二者混合即可剧烈反应生成氮气和水,若0.5 mol肼完全被氧化放出408.8 kJ的热量。则6.4 g液态肼完全被氧化转移电子的数目为
)作还原剂,二者混合即可剧烈反应生成氮气和水,若0.5 mol肼完全被氧化放出408.8 kJ的热量。则6.4 g液态肼完全被氧化转移电子的数目为 ,放出的热量为
,放出的热量为
您最近一年使用:0次
8 . 已知:在25℃、101kPa下,由最稳定的单质生成1 mol物质的反应焓变叫作该物质的标准摩尔生成焓,规定稳定单质的标准摩尔生成焓为0.下表为几种常见物质的标准摩尔生成焓的数值。则下列说法或热化学方程式正确的是
| 物质 |  |  |  |  |  |
标准摩尔生成焓/(kJ·mol ) ) | -283 | -241.8 | 91.3 | -45.9 | -393.5 |
A.2 mol  的键能大于1 mol 的键能大于1 mol  与1 mol 与1 mol  的键能之和 的键能之和 |
B.  kJ⋅mol kJ⋅mol |
C.  kJ·mol kJ·mol |
| D.工业上用CO消除NO污染的反应是吸热反应 |
您最近一年使用:0次
名校
9 . 利用图1 和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验。下列说法正确的是


| A.H2O2中只含有极性共价键,不含离子键 |
B.2NO2 N2O4的平衡常数K随温度升高而减小 N2O4的平衡常数K随温度升高而减小 |
| C.向H2O2中加入Fe2(SO4)3后,B中颜色较快变浅 |
| D.H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的ΔH减小 |
您最近一年使用:0次
10 . 已知4g氢气完全燃烧生成水蒸气时放出的热量为484kJ,16g氧气中O=O键完全断裂时吸收的热量为248kJ,水蒸气中1mol H-O键形成时放出的热量为463kJ,H2O(l) =H2O(g) ΔH=+44 kJ/mol。下列说法错误的是
| A.电解9g液态水,吸收的热量为143kJ |
| B.常温下,氢气的燃烧热ΔH=-242kJ/mol |
| C.1mol H-H键断裂时吸收的热量为436kJ |
| D.0.5mol H2完全燃烧生成水蒸气,放出的热量为121kJ |
您最近一年使用:0次



