名校
1 . 对于反应A(g)+3B(g)=2C(g)+2D(g),在不同条件下的化学反应速率如下,其中反应速率最快的是
| A.v(A)=0.3mol•L-1•s-1 | B.v(B)=1.8mol•L-1•s-1 |
| C.v(D)=0.7mol•L-1•s-1 | D.v(C)=1.5mol•L-1•s-1 |
您最近半年使用:0次
名校
2 . 在A十3B 2C(A、B、C均为气体)反应中,表示该反应速率最快的是
2C(A、B、C均为气体)反应中,表示该反应速率最快的是
 2C(A、B、C均为气体)反应中,表示该反应速率最快的是
2C(A、B、C均为气体)反应中,表示该反应速率最快的是| A.v(A)=0.4mol/(L·s) | B.v(B)=0.9mol/(L·s) |
| C.v(C)=0.7 mol /(L·s) | D.v(A)=0.6mol/(L·s) |
您最近半年使用:0次
2023-04-19更新
|
160次组卷
|
2卷引用:重庆市江津第五中学校2022-2023学年高一下学期期中考试化学试题
3 . 下列说法正确的是
| A.化学反应速率通常用单位时间内反应物或生成物的质量变化来表示 |
| B.用不同物质的浓度变化表示同一时间内、同一反应的速率时,其数值之比等于化学方程式中的计量数之比 |
| C.化学反应速率指的是某时刻的瞬时速率 |
| D.化学反应速率的单位由时间单位和物质的量的单位决定 |
您最近半年使用:0次
2023-04-19更新
|
362次组卷
|
2卷引用:重庆市江津第五中学校2022-2023学年高一下学期期中考试化学试题
名校
4 . 已知反应: ,生成
,生成 的初始速率与
的初始速率与 、
、 的初始浓度的关系可表示为
的初始浓度的关系可表示为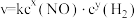 ,
, 为速率常数,在800℃时测定相关数据如下表:
为速率常数,在800℃时测定相关数据如下表:
下列说法不正确的是
 ,生成
,生成 的初始速率与
的初始速率与 、
、 的初始浓度的关系可表示为
的初始浓度的关系可表示为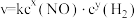 ,
, 为速率常数,在800℃时测定相关数据如下表:
为速率常数,在800℃时测定相关数据如下表:| 实验 | 初始浓度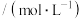 | 生成 的初始速率 的初始速率 | |
| 序号 | 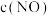 |  | 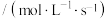 |
| 1 | 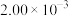 | 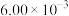 | 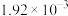 |
| 2 | 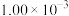 | 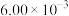 | 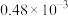 |
| 3 | 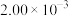 | 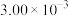 | 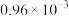 |
A.式中 , ,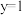 |
B.800℃时,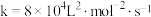 |
C.当其他条件不变时,升高温度,速率常数 增大 增大 |
D.若起:始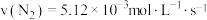 ,则 ,则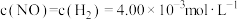 |
您最近半年使用:0次
2023-03-28更新
|
607次组卷
|
2卷引用:重庆市万州第二高级中学2022-2023学年高三下学期第五次质量检测化学试题
名校
5 . 对于反应A(g)+3B(g)=2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
| A.v(A)=0.01 mol·L-1·s-1 | B.v(B)=0.02 mol·L-1·s-1 |
| C.v(B)=0.60 mol·L-1·min-1 | D.v(C)=1.0 mol·L-1·min-1 |
您最近半年使用:0次
2023-03-03更新
|
189次组卷
|
3卷引用:重庆市荣昌永荣中学校2021-2022学年高二上学期期中考试化学试题
名校
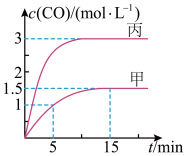
6 . 一定条件下,向甲、乙、丙三个恒容容器中加入一定量初始物质,发生反应C(s)+H2O(g) CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
下列说法正确的是
 CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 0.5 | 0.5 | V |
| 温度/K |  |  |  |
| 起始量 | 1molC(s),1mol H2O (g) | 1molCO(g),1mol H2(g) | 3molC(s),2mol H2O (g) |
A.甲容器中,从反应开始到平衡的平均反应速率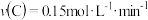 |
| B.温度为T1时,反应的平衡常数K=9 mol∙L-1, |
C.乙容器中,若平衡时n(C)=0.19mol,则 |
| D.V=0.4 |
您最近半年使用:0次
名校
7 . 设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:
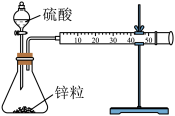
①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、 注射器、铁架台、
注射器、铁架台、_______ 。
(2)观察到的现象是_______ ;收集10mL气体②所用时间比①所用时间_______ 。
(3)所能得出的实验结论是_______ 。
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式_______ 。
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为 (若折合成
(若折合成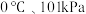 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
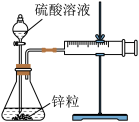

①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、
 注射器、铁架台、
注射器、铁架台、(2)观察到的现象是
(3)所能得出的实验结论是
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为
 (若折合成
(若折合成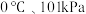 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
A.用锌粒表示的10s内该反应的速率为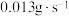 |
B.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
C.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
D.用 表示的 表示的 内该反应的速率为 内该反应的速率为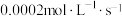 |
您最近半年使用:0次
2022-10-07更新
|
156次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期第一次月考化学试题
名校
8 . 在甲、乙两个密闭容器中分别充入一定量的SO2和O2,一段时间后,测得两容器中反应的反应速率: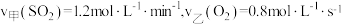 ,则反应速率
,则反应速率
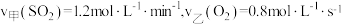 ,则反应速率
,则反应速率| A.甲>乙 | B.乙>甲 | C.甲=乙 | D.无法判断 |
您最近半年使用:0次
2022-10-07更新
|
173次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
9 . 在2A(g)+3B(g) = C(g)+4D(g)反应中,表示该反应的化学反应速度最快的是
| A.v(A)=0.5 mol·L-1·s-1 | B.v(B)=0.3 mol·L-1·s-1 |
| C.v(C)=0.4 mol·L-1·s-1 | D.v(D)=2.0 mol·L-1·min-1 |
您最近半年使用:0次
2022-09-01更新
|
83次组卷
|
3卷引用:重庆市长寿区2022-2023学年高一下学期期末质量监测化学(B卷)试题
名校
解题方法
10 . 氮及其化合物在工农业生产生活中有着重要作用。
(1)若在一容积为2L的密闭容器中加入0.4mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=_______ mol·L-1·min-1,平衡时H2的转化率为_______ %,平衡时容器内压强是反应开始时的_______ 倍,平衡时NH3的体积分数为_______ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“<”“>”或“=”);
②400℃时,测得容器内NH3、N2和H2物质的量分别为3mol、2mol和1mol,则该反应的v(N2)正____ v(N2)逆(填“<”“>”或“=”)。
(4)研究表明,合成氨的速率与相关物质的浓度关系为v= ,k为速率常数。以下说法正确的是_______(填字母序号)。
,k为速率常数。以下说法正确的是_______(填字母序号)。
(1)若在一容积为2L的密闭容器中加入0.4mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,测得容器内NH3、N2和H2物质的量分别为3mol、2mol和1mol,则该反应的v(N2)正
(4)研究表明,合成氨的速率与相关物质的浓度关系为v=
 ,k为速率常数。以下说法正确的是_______(填字母序号)。
,k为速率常数。以下说法正确的是_______(填字母序号)。| A.升高温度,k值增大 |
| B.温度一定时,若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态 |
| C.一定温度下将原容器中的NH3及时分离出来可使v减小 |
| D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大。 |
您最近半年使用:0次



