名校
1 . 一定条件下,向甲、乙、丙三个恒容容器中加入一定量初始物质,发生反应C(s)+H2O(g) CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
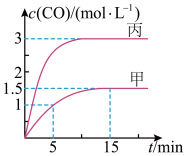
下列说法正确的是
 CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) ∆H>0,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 0.5 | 0.5 | V |
| 温度/K |  |  |  |
| 起始量 | 1molC(s),1mol H2O (g) | 1molCO(g),1mol H2(g) | 3molC(s),2mol H2O (g) |
A.甲容器中,从反应开始到平衡的平均反应速率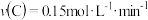 |
| B.温度为T1时,反应的平衡常数K=9 mol∙L-1, |
C.乙容器中,若平衡时n(C)=0.19mol,则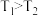 |
| D.V=0.4 |
您最近一年使用:0次
名校
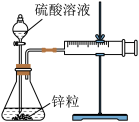
2 . 设计实验测定锌与硫酸反应的速率,按下列实验步骤完成实验:
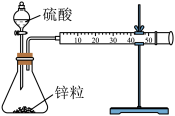
①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、 注射器、铁架台、
注射器、铁架台、_______ 。
(2)观察到的现象是_______ ;收集10mL气体②所用时间比①所用时间_______ 。
(3)所能得出的实验结论是_______ 。
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式_______ 。
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为 (若折合成
(若折合成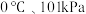 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。

①按图示安装置,加入锌粒,然后快速加入40mL1mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
②按图示再安转一套装置,加入与前一套装置相同的锌粒,然后再快速加入40mL4mol∙L-1的硫酸溶液,测量收集10mLH2所用的时间。
回答下列问题:
(1)实验所用仪器有:锥形瓶、双孔塞、分液漏斗、直角导气管、
 注射器、铁架台、
注射器、铁架台、(2)观察到的现象是
(3)所能得出的实验结论是
(4)利用硫代硫酸钠或重铬酸钾与上述稀硫酸反应也可判断反应速率的快慢,请书写这两个反应的离子方程式
(5)某温度下按如图装置进行实验,锥形瓶内盛有6.5g锌粒(颗粒大小基本相同),通过分液漏斗加入40mL2.5mol∙L-1的硫酸溶液,将产生的H2收集在一个注射器中,用时10s时恰好收集到气体的体积为
 (若折合成
(若折合成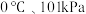 条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
条件下的H2体积为44.8mL)。在该温度下,下列说法正确的是_______。
A.用锌粒表示的10s内该反应的速率为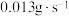 |
B.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
C.忽略锥形瓶内溶液体积的变化,用 表示的 表示的 内该反应的速率为 内该反应的速率为 |
D.用 表示的 表示的 内该反应的速率为 内该反应的速率为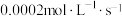 |
您最近一年使用:0次
2022-10-07更新
|
158次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期第一次月考化学试题
名校
3 . 在甲、乙两个密闭容器中分别充入一定量的SO2和O2,一段时间后,测得两容器中反应的反应速率: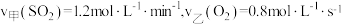 ,则反应速率
,则反应速率
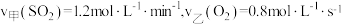 ,则反应速率
,则反应速率| A.甲>乙 | B.乙>甲 | C.甲=乙 | D.无法判断 |
您最近一年使用:0次
2022-10-07更新
|
174次组卷
|
2卷引用:重庆市九龙坡区2022-2023学年高二上学期第一次月考化学试题
名校
解题方法
4 . 氮及其化合物在工农业生产生活中有着重要作用。
(1)若在一容积为2L的密闭容器中加入0.4mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=_______ mol·L-1·min-1,平衡时H2的转化率为_______ %,平衡时容器内压强是反应开始时的_______ 倍,平衡时NH3的体积分数为_______ %。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
(3)若在0.5L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
①试比较K1、K2的大小,K1_______ K2(填“<”“>”或“=”);
②400℃时,测得容器内NH3、N2和H2物质的量分别为3mol、2mol和1mol,则该反应的v(N2)正____ v(N2)逆(填“<”“>”或“=”)。
(4)研究表明,合成氨的速率与相关物质的浓度关系为v= ,k为速率常数。以下说法正确的是_______(填字母序号)。
,k为速率常数。以下说法正确的是_______(填字母序号)。
(1)若在一容积为2L的密闭容器中加入0.4mol的N2和0.6mol的H2在一定条件下发生反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2mol。则前5分钟的平均反应速率v(N2)=
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
| A.加了催化剂 | B.增大容器体积 |
| C.降低反应体系的温度 | D.加入一定量N2 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②400℃时,测得容器内NH3、N2和H2物质的量分别为3mol、2mol和1mol,则该反应的v(N2)正
(4)研究表明,合成氨的速率与相关物质的浓度关系为v=
 ,k为速率常数。以下说法正确的是_______(填字母序号)。
,k为速率常数。以下说法正确的是_______(填字母序号)。| A.升高温度,k值增大 |
| B.温度一定时,若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态 |
| C.一定温度下将原容器中的NH3及时分离出来可使v减小 |
| D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大。 |
您最近一年使用:0次
解题方法
5 . 反应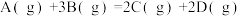 在四种不同情况下的反应速率分别如下:
在四种不同情况下的反应速率分别如下:
① ②
②
③ ④
④
则该反应进行的快慢顺序为
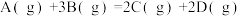 在四种不同情况下的反应速率分别如下:
在四种不同情况下的反应速率分别如下:①
 ②
②
③
 ④
④
则该反应进行的快慢顺序为
| A.④>③>②>① | B.①>④>②>③ |
| C.④>③=②>① | D.①>④>③>② |
您最近一年使用:0次
名校
6 . 对于反应A(g)+3B(g)⇌2C(g)+2D(s),下列各数据表示不同条件下的反应速率,其中应进行得最快的是
| A.v(A)=0.2mol/(L∙s) | B.v(B)=1.2mol/(L∙min) |
| C.v(C)=0.3mol(L∙s) | D.v(D)=0.5mol(L∙s) |
您最近一年使用:0次
2021-05-20更新
|
368次组卷
|
6卷引用:重庆市第七中学校2020-2021学年高一下学期5月月考化学试题
名校
7 . 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示。则下列对该反应的推断合理的是
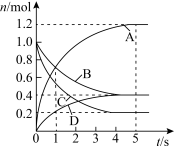

A.该反应的化学方程式为6A+2D 3B+4C 3B+4C |
| B.反应进行到1s时,v(A)=v(B) |
| C.反应进行到5s时,B的平均反应速率为0.12mol/(L·s) |
| D.反应从1s到4s时,C的反应速率逐渐减小 |
您最近一年使用:0次
2021-04-06更新
|
361次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题
名校
8 . 反应:4NH3+5O2═4NO+6H2O,下列关系正确的是( )
A.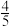 v(NH3)=v(O2) v(NH3)=v(O2) | B.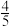 v(O2)=v(NO) v(O2)=v(NO) |
C.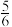 v(O2)=v(H2O) v(O2)=v(H2O) | D. v(NH3)=v(H2O) v(NH3)=v(H2O) |
您最近一年使用:0次
2019-11-25更新
|
469次组卷
|
6卷引用:重庆市第七中学校2020-2021学年高二上学期12月考化学试题
名校
9 . 人体内的血红蛋白(Hb)和肌红蛋白(Mb)均可与O2结合,Hb也可以与CO结合。
已知:反应①:Hb(aq)+O2(g) HbO2(aq) ∆H1<0;
HbO2(aq) ∆H1<0;
反应②:Hb(aq)+CO(g) HbCO(aq) ∆H2<0
HbCO(aq) ∆H2<0
反应③:HbO2(aq)+CO(g) HbCO(aq)+O2(g) ∆H3
HbCO(aq)+O2(g) ∆H3
(1)∆H3=_____ (用∆H1、∆H2表示);反应③自发进行的趋势较大,则∆H1_____ ∆H2(填“>”、“<”或“=”)
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是_____ 。
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g)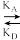 MbO2(aq) ∆H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) ∆H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是__________ 。
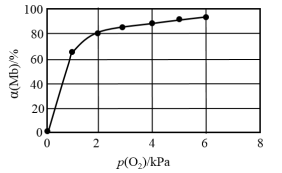
②该反应平衡总数的表达式为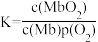 ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=_______ ,a(Mb)=________ (用含p(O2)的式子表示)。
③ T℃时,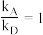 kPa-1,则T
kPa-1,则T______ 37(填“>”、“<”或“=”),理由是________________ 。
已知:反应①:Hb(aq)+O2(g)
 HbO2(aq) ∆H1<0;
HbO2(aq) ∆H1<0;反应②:Hb(aq)+CO(g)
 HbCO(aq) ∆H2<0
HbCO(aq) ∆H2<0反应③:HbO2(aq)+CO(g)
 HbCO(aq)+O2(g) ∆H3
HbCO(aq)+O2(g) ∆H3(1)∆H3=
(2)CO中毒者应立即转移至空气新鲜的地方,结合反应③,从平衡移动的原理分析这样做的理由是
(3)肌红蛋白结合O2的化学方程式为Mb(aq)+O2(g)
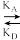 MbO2(aq) ∆H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。
MbO2(aq) ∆H<0,研究发现,37℃ 时,v正=kAc(Mb)p(O2),v逆=kDc(MbO2)(kA和kD分别是正向和逆向反应的速率常数)。①对于CO中毒的病人,为解毒需要将v正提高到正常人的4倍,假设病人体内c(Mb)与常人相同,空气中p(O2)为20.0kPa,则解毒时提供病人呼吸的O2的压强是
②该反应平衡总数的表达式为
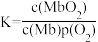 ,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=
,37℃时,反应达平衡时测得Mb与O2结合度[a(Mb),即Mb的转化率]的一组实验如下图所示,则37℃时该反应的K=
③ T℃时,
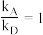 kPa-1,则T
kPa-1,则T
您最近一年使用:0次
2019-04-26更新
|
464次组卷
|
2卷引用:【全国百强校】重庆市第一中学校2019届高三下学期4月月考理科综合化学试题
名校
解题方法
10 . 我国煤炭资源丰富,通过煤的气化和液化。能使煤炭得以更广泛的应用。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)⇌CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
从反应开始到2min时,υ(H2)为___________________ ;该温度下反应的平衡常数K=__________ 。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正____ υ逆(填“>”、“<”或“=”)。
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
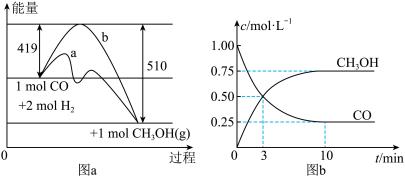
(1)在图a中,曲线_____ (填“a”或“b”)表示使用了催化剂;该反应属于_______ 反应(填“吸热”或“放热”);若保持其他条件不变,将反应体系升温,则该反应的平衡常数将______ (填“变大”、“变小”或“不变”)。
(2)下列说法正确的是_______ (填序号)。
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时 会减小
会减小
(3)若在相同情况下,最初向容器中充入____ mol CH3OH(g),可以达到上述同样的平衡状态。
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1<T2)。____________
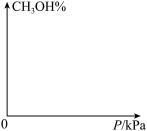 。
。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)⇌CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.20 | 0.20 |
| n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.60 | 0.60 |
从反应开始到2min时,υ(H2)为
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g)
 CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
(1)在图a中,曲线
(2)下列说法正确的是
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时
 会减小
会减小(3)若在相同情况下,最初向容器中充入
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1<T2)。
 。
。
您最近一年使用:0次



