1 . 将等物质的量的A、B混合于5L的密闭容器中,发生反应: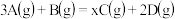 ,经5min后,测得D的浓度为
,经5min后,测得D的浓度为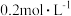 ,
, ,C的平均反应速率是
,C的平均反应速率是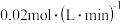 。
。 请写出计算过程
请写出计算过程 求:
求:
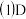 的平均反应速率
的平均反应速率_____ ;
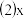 的值
的值_____ ;
 反应开始前放入容器中的A、B的物质的量
反应开始前放入容器中的A、B的物质的量_____ ;
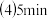 时B的物质的量浓度
时B的物质的量浓度_____ 。
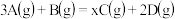 ,经5min后,测得D的浓度为
,经5min后,测得D的浓度为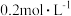 ,
, ,C的平均反应速率是
,C的平均反应速率是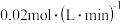 。
。 请写出计算过程
请写出计算过程 求:
求: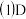 的平均反应速率
的平均反应速率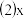 的值
的值 反应开始前放入容器中的A、B的物质的量
反应开始前放入容器中的A、B的物质的量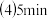 时B的物质的量浓度
时B的物质的量浓度
您最近一年使用:0次
2 . 把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g),2min末生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol•L﹣1 •min﹣1,试计算(写出计算过程)
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
您最近一年使用:0次
名校
3 . 在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y=2Z,如图所示是该反应中X的物质的量随时间变化的曲线。

(1)2 min内的平均速率是________ ;
(2)4 min内的平均速率是____________ 。

(1)2 min内的平均速率是
(2)4 min内的平均速率是
您最近一年使用:0次
11-12高二下·江苏淮安·期中
名校
4 . 对A+3B=2C+2D来说,下列四种不同情况下的反应速率最快的是
| A.υ(A)=0.25 mol/(L·min) | B.υ(B)=0.6 mol/(L·min) |
| C.υ(C)=0.5 mol/(L·min) | D.υ(D)=0.6 mol/(L·min) |
您最近一年使用:0次
2018-10-18更新
|
141次组卷
|
5卷引用:【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题(已下线)2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(已下线)2011-2012学年河北省辛集三中高二化学选修四期中试卷青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
5 . 根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________ 。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①则从反应开始到20min时,以NO表示的平均反应速率=________ ,该温度下该反应的平衡常数K=____ (保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____ (写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________ ;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
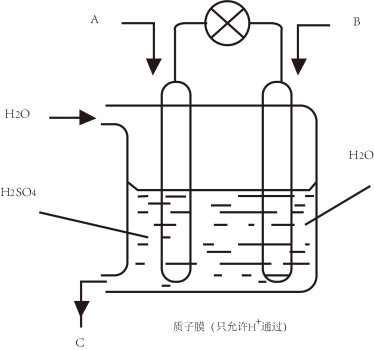
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________ ,电池总反应式为________________________ 。
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20min时,以NO表示的平均反应速率=
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
③下列描述中能说明上述反应已达平衡的是
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为
您最近一年使用:0次
2018-09-28更新
|
934次组卷
|
5卷引用:【全国百强校】青海省西宁市第四高级中学2019届高三上学期第一次模拟考试理科综合化学试题
11-12高二·全国·课时练习
名校
6 . 将N2、H2混合气体分别充入甲、乙、丙三个容器中进行合成氨反应,经过一段时间后反应速率为:甲 v(H2)=3mol·(L·min)-1;乙 v(N2)=2mol·(L·min)-1;丙 v(NH3)=1mol·(L·min)-1。在这段时间内三个容器中合成氨的反应速率
| A.甲>乙>丙 | B.甲=乙=丙 | C.乙>甲>丙 | D.甲>丙>乙 |
您最近一年使用:0次
2018-06-27更新
|
228次组卷
|
8卷引用:青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题
青海省北外附属西宁新华联国际学校2020-2021学年高二上学期期末考试化学试题(已下线)2012年人教版高中化学选修4 2.1化学反应速率练习卷(已下线)2012年鲁科版高中化学选修4 2.2化学反应的限度练习卷2014-2015福建省福州市第八中学高二下学期期中化学试卷云南省西双版纳州民族中学2017-2018学年高一6月月考化学试题福建省莆田市第八中学2018-2019学年高二(理)上学期期中考试化学试题云南省石屏县二中2019-2020学年高二上学期开学考试化学试题福建省宁德第一中学2023-2024学年高二上学期9月月考化学试题
名校
7 . 对于可逆反应2A(g)+3B(g)  4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
 4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
4C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是| A.v(A)=0.9 mol·L-1·min-1 | B.v(B)=1.5 mol·L-1·min-1 |
| C.v(D)=0.8 mol·L-1·min-1 | D.v(C)=0.1 mol·L-1·s-1 |
您最近一年使用:0次
2018-01-31更新
|
534次组卷
|
4卷引用:青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题
名校
8 . 反应4NH3+5O2 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
 4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )
4NO+6H2O在一定体积的密闭容器中进行,30 s后NO的物质的量浓度增加了3 mol/L,则下列反应速率正确的是( )| A.v(NO)=0.1 mol·(L·s)-1 | B.v(NO)=0.02 mol·(L·s)-1 |
| C.v(NH3)=0.01 mol·(L·s)-1 | D.v(NH3)=0.2 mol·(L·s)-1 |
您最近一年使用:0次
2017-11-07更新
|
192次组卷
|
4卷引用:【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题
名校
9 . 向容积为2L的密闭容器中充入2molA气体和1mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
3C(g);经2s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是( )
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
| A.①②③ | B.①③ | C.②④ | D.①④ |
您最近一年使用:0次
2017-11-02更新
|
1093次组卷
|
10卷引用:青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题
青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题安徽省定远重点中学2017-2018学年高一下学期第一次月考化学试题云南省腾冲市第八中学2018-2019学年高一(理)下学期期中考试化学试题山西省朔州市怀仁县第一中学2018-2019学年高一下学期第三次月考化学试题天津市第二南开学校2019-2020学年高一下学期阶段性检测化学试题江西省上饶市横峰中学2019-2020学年高一(统招班)下学期入学考试化学试题辽宁省锦州市黑山县黑山中学2019-2020学年高一下学期线上教学检测化学试题云南省昆明市官渡区第一中学2019-2020学年高二上学期开学考试化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题山西省大同市浑源七中2022-2023学年高一下学期第三次月考化学试题
10 . 减少工业和生活废弃物的排放并合理开发利用,近年来受到了人们的普遍关注。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
(1)已知下列反应的能量变化如图所示:
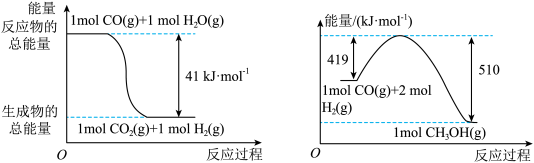
由二氧化碳和氢气制备甲醇的热化学方程式为____________________________ 。
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为__________________ 。
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=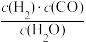 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式____________________________ 。
(4)T ℃时,能发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
此刻正、逆反应速率的关系是v(正)_______ (填“>”、“<”或“=”)v(逆),平衡时c(CH3OCH3)是___________ 。
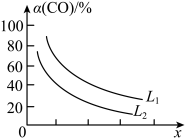
(5)已知反应3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示_________ (填“温度”或“压强”),判断的理由是_______________________ 。
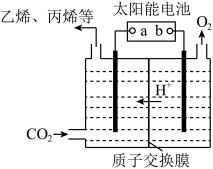
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的_____ 极。电解时,生成乙烯的电极反应式为_________________________ 。
Ⅰ.利用工业废水中的CO2制取甲醇,反应为CO2+3H2
 CH3OH+H2O。
CH3OH+H2O。(1)已知下列反应的能量变化如图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为
Ⅱ.利用工业废气CO合成甲醇,反应为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。(2)一定条件下,在1 L密闭容器中充入0.6 mol CO和1.4 mol H2,8 min后达到平衡,CO的转化率为50%,则8 min内H2的平均反应速率为
(3)若反应原料是来自煤的气化,已知该反应的平衡常数表达式为K=
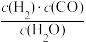 ,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式
,每生成1 mol H2需要吸收131.3 kJ的热量。写出该反应的热化学方程式(4)T ℃时,能发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:
CH3OCH3(g)+H2O(g)。已知反应平衡常数为400,此温度下,在1 L密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如表:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.46 | 1.0 | 1.0 |
此刻正、逆反应速率的关系是v(正)

(5)已知反应3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示。图中X表示
(6)强酸性电解质溶液中,用惰性电极电解CO2可转化为多种燃料,其原理如图所示。b为电源的
您最近一年使用:0次
2017-04-12更新
|
350次组卷
|
4卷引用:青海省西宁市2017届高三下学期复习检测一(一模)理综-化学试题
青海省西宁市2017届高三下学期复习检测一(一模)理综-化学试题(已下线)2019年5月1日 《每日一题》三轮复习-化学反应原理综合题(已下线)2019年5月16日 《每日一题》四轮复习——押高考化学第28题(1)新疆维吾尔自治区和田地区洛浦县2022-2023学年高二上学期11月期中考试化学试题



