1 . 某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图1所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_______ 。
(2)若X、Y、Z均为气体,反应恰好达到平衡时,用Z表示的平均反应速率为_______ ;
(3)在一密闭容器中发生反应 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。
,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。
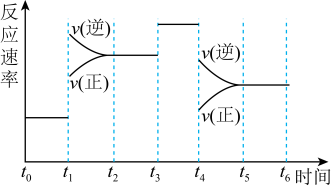
判断t1、t3、t4时刻分别改变的一个条件是:t1时刻_______ ;t3时刻_______ ;t4时刻_______
(填字母代号)
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.恒温恒容时充入氮气

(1)该反应的化学方程式为
(2)若X、Y、Z均为气体,反应恰好达到平衡时,用Z表示的平均反应速率为
(3)在一密闭容器中发生反应
 ,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。
,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图2所示。
判断t1、t3、t4时刻分别改变的一个条件是:t1时刻
(填字母代号)
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.恒温恒容时充入氮气
您最近一年使用:0次
2 . 硫酸的消费量常用来衡量一个国家工业发展水平,其中 的催化氧化是重要的一步。
的催化氧化是重要的一步。
I.科研人员使用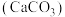 为基础固硫材料,复合不同的催化剂(
为基础固硫材料,复合不同的催化剂(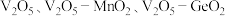 )催化
)催化 向
向 的转化,同时研究了不同温度下使用三种催化剂对
的转化,同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响如下图:
转化率表示)的影响如下图:
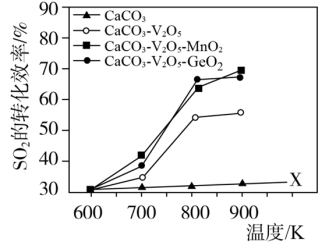
(1)仅使用 而不使用催化剂获得X线的实验目的是
而不使用催化剂获得X线的实验目的是_______ ﹔
(2)下列有关说法正确的是_______
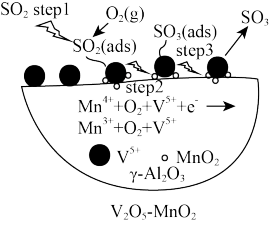
a.三种催化剂中 催化剂效率最低
催化剂效率最低
b.同温同压下,使用复合催化剂有利于提高 的平衡产率
的平衡产率
c.如上图为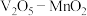 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知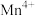 比
比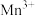 更易获得电子
更易获得电子
d.温度越高一定越有利于催化剂催化效率的提升
(3)某 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: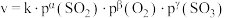 ,根据表中数据可得:
,根据表中数据可得:
_______ 、
_______ 、
_______ 。
Ⅱ.在恒温恒压下,向密闭容器中充入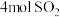 和
和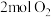 混合气体,
混合气体, 后,反应达到平衡,生成
后,反应达到平衡,生成 气体
气体 ,同时放出热量
,同时放出热量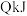 。请回答下列问题:
。请回答下列问题:
(4)该反应的热化学方程式为_______ 。
(5)在该条件下,反应前后容器的体积之比为_______ 。
(6)若把“恒温恒压”改为“恒压绝热条件”反应,平衡后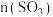
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 的催化氧化是重要的一步。
的催化氧化是重要的一步。I.科研人员使用
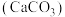 为基础固硫材料,复合不同的催化剂(
为基础固硫材料,复合不同的催化剂(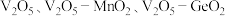 )催化
)催化 向
向 的转化,同时研究了不同温度下使用三种催化剂对
的转化,同时研究了不同温度下使用三种催化剂对 固硫效率(用单位时间
固硫效率(用单位时间 转化率表示)的影响如下图:
转化率表示)的影响如下图:
(1)仅使用
 而不使用催化剂获得X线的实验目的是
而不使用催化剂获得X线的实验目的是(2)下列有关说法正确的是

a.三种催化剂中
 催化剂效率最低
催化剂效率最低b.同温同压下,使用复合催化剂有利于提高
 的平衡产率
的平衡产率c.如上图为
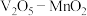 为催化剂时的反应机理,由图可知
为催化剂时的反应机理,由图可知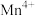 比
比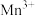 更易获得电子
更易获得电子d.温度越高一定越有利于催化剂催化效率的提升
(3)某
 催化氧化生成
催化氧化生成 反应的速率方程为:
反应的速率方程为: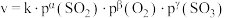 ,根据表中数据可得:
,根据表中数据可得:


| 实验 | 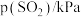 | 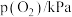 | 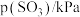 | 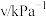 |
| 1 | m | n | p | q |
| 2 | 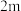 | n | p |  |
| 3 | m | n |  | 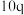 |
| 4 | m |  | p | 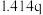 |
Ⅱ.在恒温恒压下,向密闭容器中充入
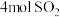 和
和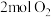 混合气体,
混合气体, 后,反应达到平衡,生成
后,反应达到平衡,生成 气体
气体 ,同时放出热量
,同时放出热量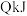 。请回答下列问题:
。请回答下列问题:(4)该反应的热化学方程式为
(5)在该条件下,反应前后容器的体积之比为
(6)若把“恒温恒压”改为“恒压绝热条件”反应,平衡后
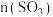
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
2022-11-14更新
|
235次组卷
|
4卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
名校
3 . 为早日实现“碳达峰”、“碳中和”,我国科学家利用 作为催化剂,实现了常温下
作为催化剂,实现了常温下 加氢制
加氢制 ,主反应为
,主反应为
 ,伴随发生副反应
,伴随发生副反应
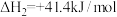
(1)已知
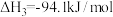 ,则
,则
_______  。
。
(2)在恒温恒容的密闭容器中,加入 和
和 ,同时发生主、副反应。体系中
,同时发生主、副反应。体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:

①
_______  。
。
② 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是_______ 。
③下列说法正确的是_______ 。
A.增大压强,体系中副反应平衡逆向移动
B.体系中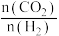 不再变化,代表反应达到平衡
不再变化,代表反应达到平衡
C.及时分离出 可以加快主反应的反应速率
可以加快主反应的反应速率
D.更换合适的催化剂可提高 的选择性
的选择性
④某温度下,若容器体积为1L,40min后,2个反应均达到平衡,此时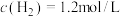 ,
, ,则
,则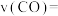
_______  ,主反应的平衡常数的计算式为
,主反应的平衡常数的计算式为_______ ,此时 的选择性为
的选择性为_______ (保留3位有效数字)。
(3)我国某研究团队发现,当选用某种Cu作催化剂时,主反应的中间体为 。此时反应分为两步:
。此时反应分为两步:
第一步:
第二步:
其中第一步的反应历程如下图所示(*表示吸附态,即该物种吸附在催化剂表面)
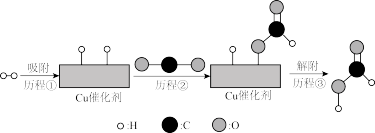
历程①: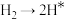
历程②:_______ (写方程式);
历程③:
我国科学家发现利用太阳能驱动 转化也可以实现上述第一步反应,原理如图所示:
转化也可以实现上述第一步反应,原理如图所示:
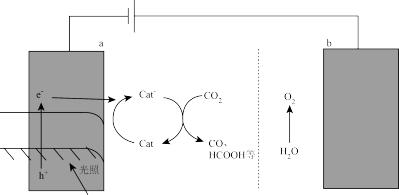
a的电极反应式为_______ ,该装置能量转化的主要形式是_______ 。
 作为催化剂,实现了常温下
作为催化剂,实现了常温下 加氢制
加氢制 ,主反应为
,主反应为
 ,伴随发生副反应
,伴随发生副反应
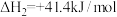
(1)已知

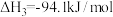 ,则
,则
 。
。(2)在恒温恒容的密闭容器中,加入
 和
和 ,同时发生主、副反应。体系中
,同时发生主、副反应。体系中 的选择性(指转化为
的选择性(指转化为 的
的 占发生反应的
占发生反应的 的百分比)随温度、压强的变化曲线如图所示:
的百分比)随温度、压强的变化曲线如图所示:
①

 。
。②
 的选择性随温度升高而降低的原因可能是
的选择性随温度升高而降低的原因可能是③下列说法正确的是
A.增大压强,体系中副反应平衡逆向移动
B.体系中
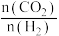 不再变化,代表反应达到平衡
不再变化,代表反应达到平衡C.及时分离出
 可以加快主反应的反应速率
可以加快主反应的反应速率D.更换合适的催化剂可提高
 的选择性
的选择性④某温度下,若容器体积为1L,40min后,2个反应均达到平衡,此时
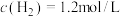 ,
, ,则
,则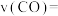
 ,主反应的平衡常数的计算式为
,主反应的平衡常数的计算式为 的选择性为
的选择性为(3)我国某研究团队发现,当选用某种Cu作催化剂时,主反应的中间体为
 。此时反应分为两步:
。此时反应分为两步:第一步:

第二步:

其中第一步的反应历程如下图所示(*表示吸附态,即该物种吸附在催化剂表面)

历程①:
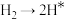
历程②:
历程③:

我国科学家发现利用太阳能驱动
 转化也可以实现上述第一步反应,原理如图所示:
转化也可以实现上述第一步反应,原理如图所示:
a的电极反应式为
您最近一年使用:0次
2022-10-29更新
|
440次组卷
|
3卷引用:青海师范大学附属实验中学2022-2023学年高三上学期12月月考化学试题
4 . 830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0。试回答下列问题:
CO2(g)+H2(g) △H>0。试回答下列问题:
(1)请写出该化学反应的平衡常数表达式:_______ 。
(2)830 K温度下,若起始时c(CO)=2 mol· L-1,c(H2O)=2 mol· L-1 ,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=_______ 。
(3)若升高温度,该反应的K值将_______ ,该反应的正反应速率将_______ ; 该反应的逆反应速率将_______ 。(填“增大”减小”或“不变”)
(4)若要提高CO的转化率,可采取的措施有:_____ (写两种)。
(5)830 K温度下,若起始时c(CO)=1 mol· L-1,c(H2O)=1 mol·L-1,反应进行5 min后,测得H2的浓度为0.5 mol·L-1,则5 min 内,H2的化学反应速率为_______ mol·L-1·min-1。
 CO2(g)+H2(g) △H>0。试回答下列问题:
CO2(g)+H2(g) △H>0。试回答下列问题:(1)请写出该化学反应的平衡常数表达式:
(2)830 K温度下,若起始时c(CO)=2 mol· L-1,c(H2O)=2 mol· L-1 ,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=
(3)若升高温度,该反应的K值将
(4)若要提高CO的转化率,可采取的措施有:
(5)830 K温度下,若起始时c(CO)=1 mol· L-1,c(H2O)=1 mol·L-1,反应进行5 min后,测得H2的浓度为0.5 mol·L-1,则5 min 内,H2的化学反应速率为
您最近一年使用:0次
2022-09-11更新
|
86次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2021-2022学年高二上学期期末考试化学试题
13-14高一·全国·期中
名校
解题方法
5 . 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:_______ ;
(2)反应开始至4min时,B的平均反应速率为_______ ,
(3)4min时,反应是否达到平衡状态?_______ (填“是”或“否”),8min时,v(正)_______ v(逆)(填“>”、“<”或“=”)。
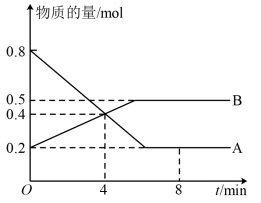
(2)反应开始至4min时,B的平均反应速率为
(3)4min时,反应是否达到平衡状态?
您最近一年使用:0次
2022-04-28更新
|
276次组卷
|
16卷引用:青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题
青海省西宁市第四高级中学2017-2018学年高二上学期第一次月考化学试题(已下线)2014年高一化学人教版必修2 期中测试练习卷(已下线)2014秋河北省成安一中、临漳一中、永年二中高二上学期期中联考化学试卷2015-2016学年甘肃会宁一中高一下期中理科化学试卷湖南省衡阳县第四中学2018-2019学年高二第一学期实验班9月月考化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题广西兴安县第三中学2019-2020学年高一下学期开学适应性检测化学试题天津市静海区四校2020-2021学年高一下学期5月份阶段性检测化学试题人教2019版必修第二册第六章 化学反应与能量复习与提高福建省厦门市湖滨中学2021-2022学年高一下学期期中考试化学试题内蒙古包头市第四中学2020-2021学年高二上学期第一次月考化学试题新疆额敏县第二中学2021-2022学年高一下学期期中考试化学试题贵州省贵阳市白云区第二高级中学2021-2022学年高一下学期期中考试化学试题江西省新余市第六中学2021-2022学年高一下学期期中考试化学试题湖南省怀化市第五中学2022-2023学年高一下学期期中考试化学试题天津市第四十三中学2023-2024学年高一下学期阶段性质量检测 化学试卷
6 . 实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),如图表示该反应过程中能量(单位为kJ·mol-1)的变化:

(1)关于该反应的下列说法中,正确的是___________(填字母)。
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。
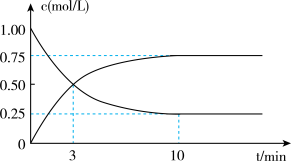
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________ ;H2的转化率w(H2) =___________ 。
②该反应的平衡常数表达式K=___________ 。
③下列措施中能使化学平衡向正反应方向移动的是___________ (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:___________ 。

(1)关于该反应的下列说法中,正确的是___________(填字母)。
| A.∆H>0,∆S>0 | B.∆H>0,∆S<0 |
| C.∆H<0,∆S<0 | D.∆H<0,∆S>0 |

①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:
您最近一年使用:0次
名校
7 . 在一定条件下的1L密闭容器中,X、Y、C三种气体的物质的量随时间的变化如图所示。下列说法不正确 的是
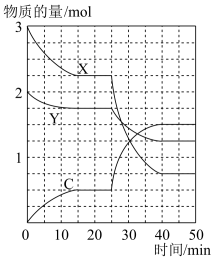

| A.0~15min,消耗C的平均速率约为0.033mol•L-1•min-1 |
B.X、Y、C三种气体发生反应的化学方程式为:Y(g)+3X(g) 2C(g) 2C(g) |
| C.反应开始到25min,X的转化率为25% |
| D.25min时改变的一个条件可能是缩小容器体积 |
您最近一年使用:0次
2021-11-13更新
|
1065次组卷
|
5卷引用:青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题
青海省西宁市城西区青海师范大学附属实验中学2022-2023学年高二上学期12月月考化学试题 浙江省宁波市2021-2022学年高三11月份选考模拟考试化学试题(已下线)第七单元 化学反应速率与化学平衡(A卷 新题基础练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)(已下线)备战2022年高考化学精准检测卷【全国卷】14江苏省徐州市沛县树恩高级中学2021-2022学年高二下学期期中测试化学试题
解题方法
8 . 反应 ,若
,若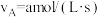 则用单位时间内C的浓度变化表示的反应速率是
则用单位时间内C的浓度变化表示的反应速率是
 ,若
,若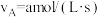 则用单位时间内C的浓度变化表示的反应速率是
则用单位时间内C的浓度变化表示的反应速率是A.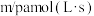 | B.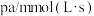 |
C. | D.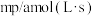 |
您最近一年使用:0次
解题方法
9 . 在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氮气的平均速率: ,则2s末NH3的浓度为
,则2s末NH3的浓度为
 ,则2s末NH3的浓度为
,则2s末NH3的浓度为| A.0.60mol/L | B.0.50 mol/L | C.0.45 mol/L | D.0.55 mol/L |
您最近一年使用:0次
10 . 碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:
(1)已知:①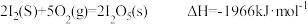
②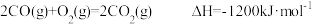
则 的
的
_______ 。
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:①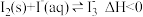 ;②
;②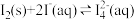 。温度降低时,反应①的平衡常数将
。温度降低时,反应①的平衡常数将_______ (填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=_______ 。
(3)碘与钨在一定温度下,可发生如下可逆反应: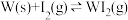 。现准确称取
。现准确称取 碘和
碘和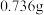 金属钨放置于
金属钨放置于 的密闭容器中,并加热使其反应。如图是混合气体中的
的密闭容器中,并加热使其反应。如图是混合气体中的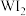 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象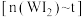 ,其中曲线Ⅰ(
,其中曲线Ⅰ( 时间段)的反应温度为
时间段)的反应温度为 ,曲线Ⅱ(从
,曲线Ⅱ(从 时刻开始)的反应温度为
时刻开始)的反应温度为 。
。
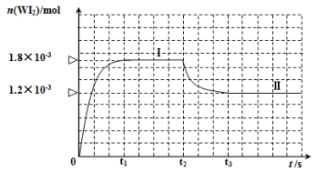
①该反应
_______ 0(填“>”或“<”);判断理由是_______ 。
②反应从开始到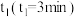 时间内
时间内 的平均反应速率
的平均反应速率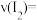
_______ 。
③能够说明上述反应已经达到平衡状态的有_______ (填选项字母)。
A. 与
与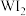 的浓度相等B.容器内各气体的浓度不再改变
的浓度相等B.容器内各气体的浓度不再改变
C.容器内混合气体的密度不再改变D.容器内气体压强不发生改变
(1)已知:①
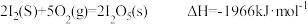
②
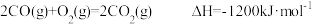
则
 的
的
(2)碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:①
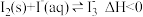 ;②
;②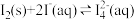 。温度降低时,反应①的平衡常数将
。温度降低时,反应①的平衡常数将(3)碘与钨在一定温度下,可发生如下可逆反应:
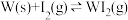 。现准确称取
。现准确称取 碘和
碘和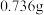 金属钨放置于
金属钨放置于 的密闭容器中,并加热使其反应。如图是混合气体中的
的密闭容器中,并加热使其反应。如图是混合气体中的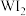 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象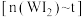 ,其中曲线Ⅰ(
,其中曲线Ⅰ( 时间段)的反应温度为
时间段)的反应温度为 ,曲线Ⅱ(从
,曲线Ⅱ(从 时刻开始)的反应温度为
时刻开始)的反应温度为 。
。
①该反应

②反应从开始到
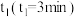 时间内
时间内 的平均反应速率
的平均反应速率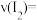
③能够说明上述反应已经达到平衡状态的有
A.
 与
与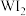 的浓度相等B.容器内各气体的浓度不再改变
的浓度相等B.容器内各气体的浓度不再改变C.容器内混合气体的密度不再改变D.容器内气体压强不发生改变
您最近一年使用:0次



