12-13高一·全国·课时练习
名校
1 . 在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6mol·L-1,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是 ( )
| A.1.2mol·L-1·min-1 | B.0.02mol·L-1·min-1 |
| C.1.8mol·L-1·min-1 | D.0.18mol·L-1·min-1 |
您最近一年使用:0次
2019-08-04更新
|
1242次组卷
|
22卷引用:2015-2016学年青海省高级中学高二上9月质检化学试卷
2015-2016学年青海省高级中学高二上9月质检化学试卷(已下线)2012年苏教版高中化学必修2 2.1化学反应速率与反应限度练习卷2014-2015学年江西省上饶市横峰中学等四校高一6月月考化学试卷2015-2016学年浙江杭州二中高一下期中化学试卷2016-2017学年新疆石河子第一中学高一下学期4月份第一次周测化学试卷安徽省黄山市2016-2017学年高一下学期期末考试化学试题内蒙古阿拉善左旗高级中学2017-2018学年高二下学期期末考试化学试题浙江省宁波市北仑中学2018-2019学年高二上学期期初返校考试化学试题山东省泰安市宁阳县第一中学2018-2019学年高一下学期期中考试化学试题宁夏长庆高级中学2018-2019学年高一下学期期末考试化学试题人教版 高中化学 必修2 第二章 《化学反应与能量》 测试卷河南省新乡市辉县市第二高级中学2019-2020学年高一下学期期中考试化学试题甘肃省天水一中2020-2021学年高二上学期开学考试化学(理科)试题内蒙古自治区呼伦贝尔市鄂温克旗第三中学2020-2021学年高二上学期期中考试化学试题人教版2019必修第二册 第六章 第二节 第1课时 化学反应的速率宁夏大学附属中学2020-2021学年高二下学期第一次月考化学试题河北省唐山市第十一中学2021-2022学年高二上学期期中考试化学试题(已下线)第09讲 化学反应速率(讲义)-【寒假自学课】2023年高一化学寒假精品课(人教版2019必修第二册)(已下线)第13讲 化学反应速率(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)第16练 化学反应的速率与限度-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05讲 化学反应速率(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)湖北省黄冈市麻城市第二中学2021-2022学年高一下学期6月月考化学试题
名校
2 . 恒温恒容时,在体积为0.5L的密闭容器中,进行NO2和N2O4之间发生反应N2O4(g)⇌2NO2(g),如图所示。

(1)曲线________ (填“X”或“Y”)表示NO2的物质的量随时间变化的曲线。
(2)若升高温度,则υ(正)________ (填“加快”或“减慢”,下同),υ(逆)________ 。
(3)若t1=10s,则用υ(NO2)=________

(1)曲线
(2)若升高温度,则υ(正)
(3)若t1=10s,则用υ(NO2)=
您最近一年使用:0次
名校
3 . 某温度时,在容积为2 L的密闭容器中,A、B的物质的量随时间变化的曲线如图所示,请据图回答下列问题:

(1)该反应的化学方程式为_______________ 。
(2)在4 min末时,A、B的物质的量浓度c(A)________ c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________ Δc(B)(以上填“>”、“<”或“=”)。
(3)反应开始至4 min时,A的平均反应速率为_______________________ 。
(4)4 min时,反应是否达到平衡状态?________ (填“是”或“否”)。8 min时,υ(正)________ (填“>”、“<”或“=”)υ(逆)。

(1)该反应的化学方程式为
(2)在4 min末时,A、B的物质的量浓度c(A)
(3)反应开始至4 min时,A的平均反应速率为
(4)4 min时,反应是否达到平衡状态?
您最近一年使用:0次
2019-06-30更新
|
450次组卷
|
5卷引用:青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题
青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题内蒙古集宁一中(西校区)2018-2019学年高一下学期期末考试化学试题(已下线)2.3.1+化学平衡状态-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)安徽省定远县育才学校2020-2021学年高二上学期第一次月考化学试题陕西省铜川市耀州中学2021-2022学年高二上学期第一次月考化学试题
4 . 把1mol X气体和0.5mol Y气体混合于2L密闭容器中,发生如下反应:3X(g)+Y(g)⇌nZ(g)+2W(g),2min末生成0.4mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol•L﹣1 •min﹣1,试计算(写出计算过程)
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
(1)前2min内,用Y表示的平均反应速率。
(2)2min末时X的转化率。
(3)化学方程式中Z的化学计量数n。
您最近一年使用:0次
名校
5 . 把0.4mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)═nZ(g)+6W(g)。2min时生成0.3mol W,此时测知以Z的浓度变化表示的反应速率为0.05mol•L﹣1•min﹣1。
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?____
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。______
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=________
试计算:
(1)前2min内用X的浓度变化表示的平均反应速率为多少?
(2)计算n值和2min末时Y的浓度(写出必要的计算过程)。
(3)室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH溶液,则n:m=
您最近一年使用:0次
6 . (1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____ ;从反应开始至2 min,Z的反应速率为______ mol·L-1·min-1。

(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_____ 。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g) 2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。t1、t3、t4时刻分别改变的一个条件是:
2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。t1、t3、t4时刻分别改变的一个条件是:
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻_____ ;t3时刻______ ;t4时刻______ (填字母)。


(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)
 2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。t1、t3、t4时刻分别改变的一个条件是:
2NH3(g) △H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。t1、t3、t4时刻分别改变的一个条件是:A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻

您最近一年使用:0次
2018-12-24更新
|
256次组卷
|
3卷引用:青海省海东市第二中学2018-2019学年高一下学期期中考试化学试题
名校
7 . 在容积为3 L的密闭容器中,放入气态物质X和Y在一定条件下发生反应2X+Y=2Z,如图所示是该反应中X的物质的量随时间变化的曲线。

(1)2 min内的平均速率是________ ;
(2)4 min内的平均速率是____________ 。

(1)2 min内的平均速率是
(2)4 min内的平均速率是
您最近一年使用:0次
11-12高二下·江苏淮安·期中
名校
8 . 对A+3B=2C+2D来说,下列四种不同情况下的反应速率最快的是
| A.υ(A)=0.25 mol/(L·min) | B.υ(B)=0.6 mol/(L·min) |
| C.υ(C)=0.5 mol/(L·min) | D.υ(D)=0.6 mol/(L·min) |
您最近一年使用:0次
2018-10-18更新
|
141次组卷
|
5卷引用:【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题
【全国百强校】青海省西宁市第四高级中学2018-2019学年高二上学期第一次月考化学试题青海省海东市第二中学2018-2019学年高二下学期第一次月考化学试题(已下线)2011-2012年江苏淮安市范集中学高二下学期期中考试化学试卷(已下线)2011-2012学年河北省辛集三中高二化学选修四期中试卷辽宁省恒仁满族自治县第二高级中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
9 . 根据题意完成下列问题:
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:_______________________________________ 。
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①则从反应开始到20min时,以NO表示的平均反应速率=________ ,该温度下该反应的平衡常数K=____ (保留两位小数)
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是_____ (写一条即可)。
③下列描述中能说明上述反应已达平衡的是__________ ;
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为_______________
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。
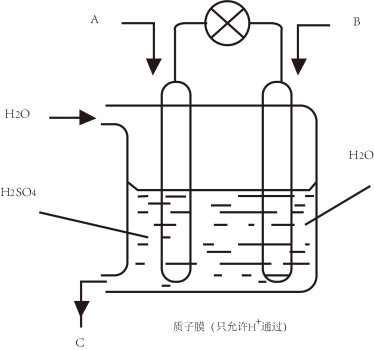
若A为SO2,B为O2,C为H2SO4,则负极反应式为_______________________________ ,电池总反应式为________________________ 。
(1)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol已知:2H2 (g) + O2 (g) = 2H2O (g) ΔH=-484 kJ/mol,写出CO完全燃烧生成CO2的热化学方程式:
(2)随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NO x、SO2、CO等大气污染气体的处理具有重要意义。用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g)
 N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)。某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:| 浓度/mol·L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
①则从反应开始到20min时,以NO表示的平均反应速率=
②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是
③下列描述中能说明上述反应已达平衡的是
A、容器内气体的平均摩尔质量保持不变
B、2v(NO)正=v(N2)逆
C、容器中气体的压强保持不变
D、单位时间内生成nmolCO2的同时生成2nmolNO
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-, 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为
(4)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。

若A为SO2,B为O2,C为H2SO4,则负极反应式为
您最近一年使用:0次
2018-09-28更新
|
934次组卷
|
5卷引用:【全国百强校】青海省西宁市第四高级中学2019届高三上学期第一次模拟考试理科综合化学试题
名校
10 . 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
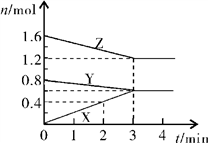
(1)该反应的化学方程式为_______________ 。
(2)反应开始至2min末,X的反应速率为________________ mol·L-1·min-1。

(1)该反应的化学方程式为
(2)反应开始至2min末,X的反应速率为
您最近一年使用:0次
2018-09-04更新
|
294次组卷
|
2卷引用:黑龙江哈尔滨市对青山镇一中2017-2018学年高一下学期期末考试化学试题



