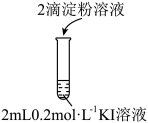
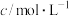1 . 室温下,下列探究方案能达到探究目的的是
| 序号 | 探究方案 | 探究目的 |
| ① | 用不同浓度、等体积的 溶液分别与相同浓度相同体积的 溶液分别与相同浓度相同体积的 溶液反应,观察现象 溶液反应,观察现象 | 探究浓度对反应速率的影响 |
| ② | 用pH计测定同浓度NaClO和NaF溶液的pH,比较溶液pH大小 | 比较HClO与HF的酸性强弱 |
| ③ | 向 和 和 混合溶液中滴加少量 混合溶液中滴加少量 溶液,观察沉淀颜色变化 溶液,观察沉淀颜色变化 | 比较CuS和ZnS的溶度积( )的大小 )的大小 |
| ④ | 向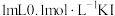 溶液中加入 溶液中加入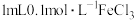 溶液,充分反应后,再加KSCN,观察溶液颜色变化 溶液,充分反应后,再加KSCN,观察溶液颜色变化 | 探究 是否完全反应 是否完全反应 |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
名校
解题方法
2 . 某化学实验小组发现镁和 溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
(1)写出钠与水反应的化学程式:___________ 。
Ⅰ.探究加快速率的粒子
(2)甲同学推测加快速率的粒子有两种:① 能加快化学反应速率。②
能加快化学反应速率。② 能加快化学反应速率。
能加快化学反应速率。
为验证猜想,进行了如下实验:
已知:Mg和 反应只能看到镁条表面有极微量气泡附着,生成的
反应只能看到镁条表面有极微量气泡附着,生成的 会附着在镁条表面阻碍反应进行:
会附着在镁条表面阻碍反应进行: 在中性或碱性条件下不与镁反应:
在中性或碱性条件下不与镁反应: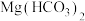 可溶于水。实验组1的目的是
可溶于水。实验组1的目的是___________ ;为了达到实验目的,实验组2应在1mol/L  溶液中
溶液中___________ 。根据以上实验,镁和 溶液反应比镁和水反应速率快的原因可能是
溶液反应比镁和水反应速率快的原因可能是___________ 。
Ⅱ.探究气体的成分
(3)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为___________ 。
(4)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是进行了如下实验,利用 传感器检测放出的气体中是否含有
传感器检测放出的气体中是否含有 。
。
得到如下曲线:
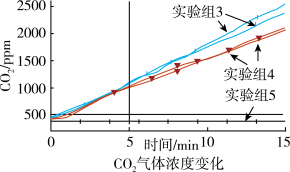
结论:
①通过上述实验,证明反应产生了 ;
;
②由图像可知,加入镁条后, 释放受到抑制,原因是:
释放受到抑制,原因是:___________ 。
(5)通过分析,镁和 溶液与
溶液与 的反应是因为
的反应是因为 发生了自偶电离:
发生了自偶电离: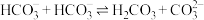 (
( 的
的 ,
, ),该反应的平衡常数是
),该反应的平衡常数是___________ (保留2位小数)。
 溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。
溶液可以反应生成气体,且比镁和水的反应速率快,通过实验探究速率加快取决于哪些粒子,同时分析气体的成分,并分析获得反应原理。(1)写出钠与水反应的化学程式:
Ⅰ.探究加快速率的粒子
(2)甲同学推测加快速率的粒子有两种:①
 能加快化学反应速率。②
能加快化学反应速率。② 能加快化学反应速率。
能加快化学反应速率。为验证猜想,进行了如下实验:
| 对照组 | 6mL 1molL 溶液( 溶液( ) ) | 持续产生大量气泡,溶液略显浑浊 |
| 实验组1 | 6mL 1mol/L 溶液 溶液 | 持续产生大量气泡,溶液略显浑浊 |
| 实验组2 | 6mL 1mol/L 溶液 溶液 | 镁表面有极微量气泡附着 |
 反应只能看到镁条表面有极微量气泡附着,生成的
反应只能看到镁条表面有极微量气泡附着,生成的 会附着在镁条表面阻碍反应进行:
会附着在镁条表面阻碍反应进行: 在中性或碱性条件下不与镁反应:
在中性或碱性条件下不与镁反应: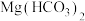 可溶于水。实验组1的目的是
可溶于水。实验组1的目的是 溶液中
溶液中 溶液反应比镁和水反应速率快的原因可能是
溶液反应比镁和水反应速率快的原因可能是Ⅱ.探究气体的成分
(3)乙同学向反应容器中滴加几滴洗洁精,形成大量泡沫时点燃气泡,听到有爆鸣声,再将产生的气体通入澄清石灰水,溶液变浑浊。由此推测气体成分为
(4)丙同学认为乙同学的推测不够严谨,逸出的气体会带出少量溶液也能使澄清石灰水变浑浊,于是进行了如下实验,利用
 传感器检测放出的气体中是否含有
传感器检测放出的气体中是否含有 。
。| 实验组3 | 取6mL 1mol/L  溶液加入250mL塑料瓶,塞紧 溶液加入250mL塑料瓶,塞紧 传感器,采集数据15min,记录液面上方 传感器,采集数据15min,记录液面上方 浓度的变化,重复实验2次。 浓度的变化,重复实验2次。 |
| 实验组4 | 取6mL 1mol/L  溶液、 溶液、 打磨好的镁条加入250mL塑料瓶,实验操作同上。 打磨好的镁条加入250mL塑料瓶,实验操作同上。 |
| 实验组5 | 用上述同样方法采集15min空塑料瓶中 浓度的数据。 浓度的数据。 |

结论:
①通过上述实验,证明反应产生了
 ;
;②由图像可知,加入镁条后,
 释放受到抑制,原因是:
释放受到抑制,原因是:(5)通过分析,镁和
 溶液与
溶液与 的反应是因为
的反应是因为 发生了自偶电离:
发生了自偶电离: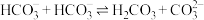 (
( 的
的 ,
, ),该反应的平衡常数是
),该反应的平衡常数是
您最近一年使用:0次
名校
解题方法
3 . 实验小组探究 溶液与
溶液与 溶液的反应:
溶液的反应:
【资料】① 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;
② 可与
可与 发生反应:
发生反应:
③在溶液中 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色
Ⅰ.实验小组设计了下列实验验证了 溶液与
溶液与 溶液的反应:
溶液的反应:
(1)实验1-1的目的是_______ 。
(2)请用离子方程式表示实验1-2中的化学反应_______ 。
Ⅱ.实验小组发现, 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
猜想1:其他条件相同时, 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)
猜想2:其他条件相同时, 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。
(3)请补全猜想1:_______ 与猜想2:_______ 。
(4)根据资料2可知 的还原性
的还原性_______ (填“强于”或“弱于”) ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为_______ (填“猜想1”或“猜想2”)的依据。
Ⅲ.为了进一步研究 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
(5)请补全表格中①_______ 与②_______
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是_______ 。
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
(8)结合实验2-2的数据,计算 内的
内的 消耗的速率
消耗的速率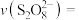
_______ 
 溶液与
溶液与 溶液的反应:
溶液的反应:【资料】①
 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;②
 可与
可与 发生反应:
发生反应:
③在溶液中
 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色Ⅰ.实验小组设计了下列实验验证了
 溶液与
溶液与 溶液的反应:
溶液的反应:编号 | 1-1 | 1-2 |
实验操作 |
|
|
现象 | 无明显现象 | 溶液立即变蓝 |
(2)请用离子方程式表示实验1-2中的化学反应
Ⅱ.实验小组发现,
 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:猜想1:其他条件相同时,
 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)猜想2:其他条件相同时,
 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。(3)请补全猜想1:
(4)根据资料2可知
 的还原性
的还原性 ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为Ⅲ.为了进一步研究
 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。编号 |
|
| 淀粉 溶液 |
| ① | 变色时间 |
2-1 |
|
| 2滴 |
| ② | 立即 |
2-2 |
|
| 2滴 |
|
|
|
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
A.增加溶液中 浓度, 浓度, 的初始反应速率会增加 的初始反应速率会增加 |
B.增加溶液中 浓度,溶液变蓝时间可能增加 浓度,溶液变蓝时间可能增加 |
C.增加溶液中 浓度,溶液可能无法变蓝 浓度,溶液可能无法变蓝 |
| D.升高溶液温度,溶液开始变蓝时间可能增加 |
 内的
内的 消耗的速率
消耗的速率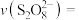

您最近一年使用:0次
4 . 请回答下列问题
(1)800℃时,在体积固定为2L的密闭容器中存在反应: ,
, 随时间的变化如下表:
随时间的变化如下表:
①如图中A点处,v(正)________ v(逆)(填“大于”、“小于”或“等于”)。
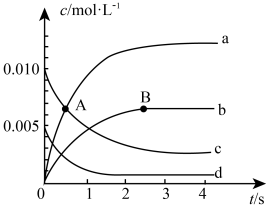
②图中表示 的变化的曲线是
的变化的曲线是________ ,用 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
________ 。
③下列不能使该反应的反应速率增大的是________ 。
a.及时分离出 气体 b.适当升高温度
气体 b.适当升高温度
c.增大 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂
(2)某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应
 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
①通过实验A、B,可探究出浓度的改变对反应速率的影响,其中
________ ,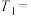
________ ;通过实验________ (实验序号)可探究出温度变化对化学反应速率的影响。
②C组实验中溶液褪色时间t________ (填“>”或“<”)8s,C组实验的反应速率
________ 。(用含有t的式子表示)
③同学们在实验中发现反应速率总是如图所示,其中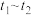 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 (或
(或 )是反应的催化剂;②
)是反应的催化剂;②________ 。

(1)800℃时,在体积固定为2L的密闭容器中存在反应:
 ,
, 随时间的变化如下表:
随时间的变化如下表:时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

②图中表示
 的变化的曲线是
的变化的曲线是 表示从0~2s内该反应的平均速率
表示从0~2s内该反应的平均速率
③下列不能使该反应的反应速率增大的是
a.及时分离出
 气体 b.适当升高温度
气体 b.适当升高温度c.增大
 的浓度 d.选择高效的催化剂
的浓度 d.选择高效的催化剂(2)某研究性学习小组利用
 溶液和酸性
溶液和酸性 溶液之间的反应
溶液之间的反应
 来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)
来探究“外界条件改变对化学反应速率的影响”,实验如下:(不考虑溶液混合所引起的体积缩小)实验序号 | 实验温度/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间/s | ||||
|
|
| |||||
V/mL |
| V/mL |
| V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
B |
| 2 | 0.02 | 3 | 0.1 |
| 8 |
C | 313 | 2 | 0.02 |
| 0.1 | 1 | t |

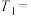
②C组实验中溶液褪色时间t

③同学们在实验中发现反应速率总是如图所示,其中
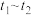 时间内速率变快的主要原因可能是:①产物
时间内速率变快的主要原因可能是:①产物 (或
(或 )是反应的催化剂;②
)是反应的催化剂;②
您最近一年使用:0次
名校
5 .  的反应速率可以用
的反应速率可以用 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。反应的速率方程为
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。反应的速率方程为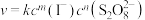 (k为速率常数,m、n为常数)。某探究性学习小组在20℃进行实验,得到的数据如下表,以下说法不正确的是
(k为速率常数,m、n为常数)。某探究性学习小组在20℃进行实验,得到的数据如下表,以下说法不正确的是
 的反应速率可以用
的反应速率可以用 遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。反应的速率方程为
遇加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。反应的速率方程为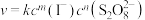 (k为速率常数,m、n为常数)。某探究性学习小组在20℃进行实验,得到的数据如下表,以下说法不正确的是
(k为速率常数,m、n为常数)。某探究性学习小组在20℃进行实验,得到的数据如下表,以下说法不正确的是| 实验编号 | ① | ② | ③ | ④ | ⑤ |
 | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
 | 0.040 | 0.040 | 0.080 | 0.020 | 0.080 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 |  |
| A.该反应的速率与反应物起始浓度的乘积成正比 |
B. |
| C.速率常数k仅与温度有关,与催化剂无关 |
D.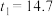 s s |
您最近一年使用:0次
名校
6 . (I)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)=4.5 mol∙L-1,反应均需要搅拌60 min。
(1)实验①和②的目的是_________
为了获得铝粉溶解量,还需要测量的数据是_________ 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1=_______ °C。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则V2=______ mL。
(4)纯铝与稀硫酸反应生成氢气的速率—时间图象如图所示:其原因为_______

(II)(1)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。
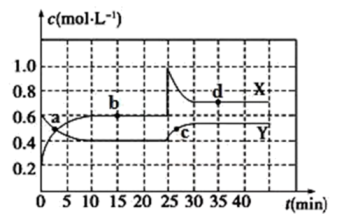
①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):_________ 。
②a、b、c、d四个点中,表示化学反应处平衡状态的点是__________ 。
(2)如图所示是可逆反应的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是____ 。
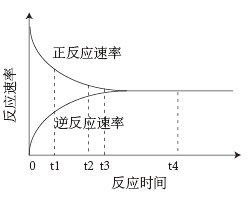
A.t1时,只有正方向反应在进行 B.t2时,反应达到最大限度
C.t3,反应逆向进行 D. t4,各物质的浓度不再发生变化
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | / |
| ④ | t2 | 5mL 0.01mol∙L-1CuSO4溶液 | 20 | V2 | 2.0050 | / |
为了获得铝粉溶解量,还需要测量的数据是
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1=
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则V2=
(4)纯铝与稀硫酸反应生成氢气的速率—时间图象如图所示:其原因为

(II)(1)在恒温条件下将一定量X和Y的混合气体通入容积为2L的密闭容器中,X和Y两物质的浓度随时间的变化情况如图所示。

①写出该反应的化学方程式(反应物或生成物用符号X、Y表示):
②a、b、c、d四个点中,表示化学反应处平衡状态的点是
(2)如图所示是可逆反应的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是

A.t1时,只有正方向反应在进行 B.t2时,反应达到最大限度
C.t3,反应逆向进行 D. t4,各物质的浓度不再发生变化
您最近一年使用:0次
名校
7 . 下列装置或操作能达到目的的是( )
 ① ① | 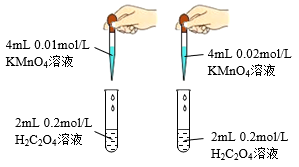 ② ② |
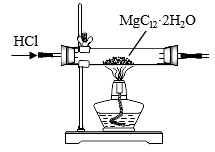 ③ ③ | 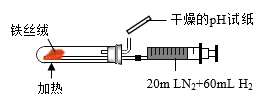 ④ ④ |
| A.装置①用滴定法测定盐酸的浓度 |
| B.装置②依据单位时间内颜色变化来比较浓度对反应速率的影响 |
| C.装置③用于制取无水MgCl2 |
| D.装置④可用于合成氨并检验氨气的生成 |
您最近一年使用:0次
2020-11-21更新
|
593次组卷
|
5卷引用:重庆市第十八中学2020-2021学年高二上学期期中考试化学试题
8 . 下列有关实验内容、实验装置和对应的实验目的均正确的是


| A.图①不能用于探究氧化性: KMnO4>Cl2>I2 |
| B.图②验证CuCl2对双氧水分解的催化作用 |
| C.图③通过测定收集一定体积氢气所用的时间来测量锌粒和一定浓度的稀硫酸反应的速率 |
| D.图④比较不同温度对化学反应速率的影响 |
您最近一年使用:0次
名校
解题方法
9 . 下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的 限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的草酸溶液,记录溶液褪色所需的时间 |
C | 证明溴乙烷的消去反应有乙烯生成 | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中 |
D | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-04-02更新
|
1408次组卷
|
7卷引用:重庆市北碚区2020届高三上学期第一次诊断性考试理综化学试题
重庆市北碚区2020届高三上学期第一次诊断性考试理综化学试题天津塘沽一中2020届高三3月网上测试化学试题(已下线)2020年高考化学押题预测卷02(新课标Ⅰ卷)--《2020年高考押题预测卷》湖北省武汉市华中师大一附中高三理科四调综合训化学试题天津市塘沽一中2020届高三第二次模拟考试化学试题西藏山南市第二高级中学2020届高三第三次模拟考试理综化学试题海南省三亚市第一中学2021-2022学年高三下学期最后一卷化学试题
名校
解题方法
10 . 某校化学课外兴趣小组为了探究影响化学反应速率的因素,做了以下实验。
(1)用三支试管各取5.0 mL、0.01 mol·L-1的酸性KMnO4溶液,再分别滴入0.1 mol·L-1 H2C2O4溶液,实验报告如下。
①实验1、3研究的是_________ 对反应速率的影响。
②表中V=_________ mL。
(2)小组同学在进行(1)中各组实验时,均发现该反应开始时很慢,一段时间后速率会突然加快。对此该小组的同学展开讨论:
①甲同学认为KMnO4与H2C2O4的反应放热,温度升高,速率加快。
②乙同学认为随着反应的进行,因_________ ,故速率加快。
(3)为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学又分别设计了如图甲、乙所示的实验。回答相关问题:
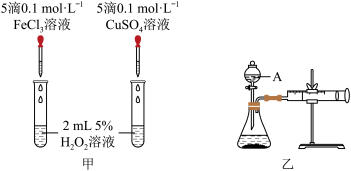
①装置乙中仪器A的名称为_________ 。
②定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是____________________________________ 。
③定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_______________ 。
(1)用三支试管各取5.0 mL、0.01 mol·L-1的酸性KMnO4溶液,再分别滴入0.1 mol·L-1 H2C2O4溶液,实验报告如下。
| 实验编号 |  KMnO4溶液 | 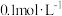 H2C2O4溶液 | 水 | 反应温度/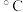 | 反应时间/s |
| 1 | 5.0mL | 5.0mL | 0 | 20 | 125 |
| 2 | 5.0mL | V | 1.0mL | 20 | 320 |
| 3 | 5.0mL | 5.0mL | 0 | 50 | 30 |
②表中V=
(2)小组同学在进行(1)中各组实验时,均发现该反应开始时很慢,一段时间后速率会突然加快。对此该小组的同学展开讨论:
①甲同学认为KMnO4与H2C2O4的反应放热,温度升高,速率加快。
②乙同学认为随着反应的进行,因
(3)为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学又分别设计了如图甲、乙所示的实验。回答相关问题:

①装置乙中仪器A的名称为
②定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是
③定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是
您最近一年使用:0次
2020-04-01更新
|
878次组卷
|
3卷引用:四川省资阳市2019-2020学年高二上学期期末质量检测化学试题