2021高三·全国·专题练习
解题方法
1 . 某兴趣小组在利用图所示装置做铜与稀硝酸反应的实验中,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
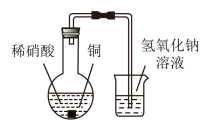
(1)图中铜与稀硝酸反应的离子方程式为___________ 。
(2)图中NaOH溶液能够吸收的有害气体是___________ 。
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
结合实验目的和表中数据,你得出的结论是___________ 。
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的___________ (填序号)。
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量______ 生成,进而认为该物质对反应有催化作用,如图所示,丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
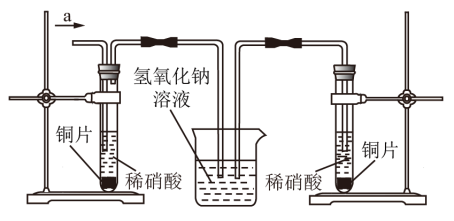
(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)

(1)图中铜与稀硝酸反应的离子方程式为
(2)图中NaOH溶液能够吸收的有害气体是
(3)小组同学提出了如下假设并设计实验探究:
I.甲同学认为反应速率变化的原因可能是反应放热导致溶液温度升高所致,故测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
II.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的
A.硝酸铜晶体 B.硝酸铜溶液 C.硫酸铜晶体 D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。故得出结论:Cu2+并不是反应的催化剂
III.丙同学根据现象推测反应过程中还有少量

(4)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中Cu2+的浓度较高所致,另一部分同学认为是该溶液中溶解了通入的物质。丁同学设计了一个实验方案证明后者的推测更为合理。(在表格中写出该同学可能的实验操作和实验现象)
| 操作 | 现象 |
您最近一年使用:0次
2 . 环氧乙烷(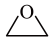 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+ O2(g)→
O2(g)→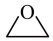 (g) ΔH1
(g) ΔH1
反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为_____ 。
②M点后曲线下降的原因为_____ 。
③下列说法正确的有_____ (填标号)。
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
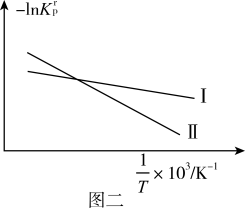
ΔH2_____ 0(填“>”或“<”)。
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→ +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
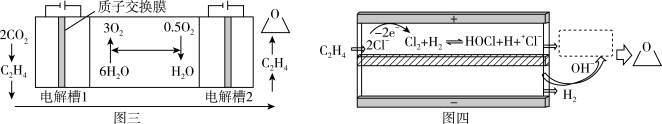
①电解槽1中阴极的电极反应式为_____ 。
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为_____ 。
 ,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:
,别称EO)是重要的杀菌剂和工业合成原料。回答下列问题:(一)乙烯直接氧化法:
反应I:CH2=CH2(g)+
 O2(g)→
O2(g)→ (g) ΔH1
(g) ΔH1反应II:CH2=CH2(g)+3O2(g)→2CO2(g)+2H2O(g) ΔH2
(1)乙烯与O2在a、b两种催化剂作用下发生反应,催化剂的催化活性(用EO%衡量)及生成EO的选择性(用EO选择性%表示)与温度(T)的变化曲线如图一所示。

①依据图给信息,选择制备环氧乙烷的适宜条件为
②M点后曲线下降的原因为
③下列说法正确的有
A.催化剂的选择性越高,其达到最高反应活性所需的温度越高
B.不同催化剂达到最高活性时的温度不同
C.催化剂的催化活性与温度成正比
(2)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。反应I、II对应的-lnK 随
随 (温度的倒数)的变化如图二所示。
(温度的倒数)的变化如图二所示。
ΔH2
(二)电化学合成法
(3)科学家利用CO2、水合成环氧乙烷,有利于实现碳中和。总反应为:2CO2+2H2O→
 +2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
+2.5O2,该过程在两个独立的电解槽中实现,装置如图三所示,在电解槽2中利用氯离子介导制备环氧乙烷,内部结构如图四所示。
①电解槽1中阴极的电极反应式为
②图四虚线框中发生多个反应,有中间产物HOCH2CH2Cl生成,最终生成环氧乙烷,其反应过程可描述为
您最近一年使用:0次
3 . 我国对世界郑重承诺:2030年前实现碳达峰,2060年前实现碳中和,而研发CO2的碳捕捉和碳利用技术则是关键。
(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g) C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1
③2CO(g) CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1
反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=____ kJ•mol-1。
(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为_____ 。

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是____ 。

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为____ mol•L-1。
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,_____ 。(结合图示,描述CO2还原为CO的过程)

(1)大气中的CO2主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
①CH4(g)
 C(s)+2H2(g) ΔH1=akJ•mol-1
C(s)+2H2(g) ΔH1=akJ•mol-1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ•mol-1
CO(g)+H2O(g) ΔH2=bkJ•mol-1③2CO(g)
 CO2(g)+C(s) ΔH3=ckJ•mol-1
CO2(g)+C(s) ΔH3=ckJ•mol-1反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的ΔH=
2CO(g)+2H2(g)的ΔH=(2)多晶Cu是目前唯一被实验证实能高效催化CO2还原为烃类(如C2H4)的金属。如图1所示,电解装置中分别以多晶Cu和Pt为电极材料,用阴离子交换膜分隔开阴、阳极室,反应前后KHCO3浓度基本保持不变,温度控制在10℃左右。生成C2H4的电极反应式为

(3)CO2的电化学催化还原具有条件温和、对环境友好的优点。Cu对CO2的电还原有一定的催化作用。在0.1mol•L-1CuSO4/H2SO4溶液中,改变沉积时间,进行恒电位沉积制备纳米Cu电极。图2是根据不同沉积时间制备的纳米Cu电极的循环伏安曲线作出的CO2的还原峰电流(峰电流越大,表明纳米Cu电极催化效果越好)与沉积时间的关系图,沉积时间超过50s,进一步延长沉积时间,纳米Cu电极催化效果减弱的原因是

(4)常温下,以NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。用1LNa2CO3溶液将2.33gBaSO4固体全都转化为BaCO3,再过滤,所用的Na2CO3溶液的物质的量浓度至少为
[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10;忽略溶液体积变化]
(5)章根强课题组通过温和的自光刻技术制备出富含氧空位的Co(CO3)0.5(OH)•0.11H2O纳米线(用CoⅡ表示),测试结果表明,该CoⅡ在可见光下具有优异的光催化CO2还原活性。分析表明,该CO2还原催化机理为典型的CoⅡ/CoI反应路径(如图3)。首先,光敏剂([Ru(bpy)3]2+)通过可见光照射被激发到激发态([Ru(bpy)3]2+*),随后([Ru(bpy)3]2+*)被TEOA淬灭得到([Ru(bpy)3]+)还原物种,该还原物种将向CoⅡ供激发电子将CoⅡ还原为CoI,

您最近一年使用:0次
2022-12-08更新
|
457次组卷
|
2卷引用:江苏省苏州中学、淮阴中学、姜堰中学、海门中学四校2023届高三上学期期中联考化学试题



