解题方法
1 . 请你查找资料,了解合成氨的工业生产中采取了哪些措施提高原料的利用率,以及合成氨工艺有哪些新的进展____ 。
您最近半年使用:0次
解题方法
2 . 某化学小组为了研究外界条件对化学反应速率的影响,进行了如表实验。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
(1)实验目的是____ 。
(2)请解释实验②中加入4.0mL蒸馏水的原因:____ 。
(3)据实验资料记载,Mn2+对该反应有催化作用。某小组同学计划设计实验验证Mn2+对该反应有催化作用,请填写表中空白。
若所加固体对反应确有催化作用,应观察到的现象是____ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色时所需时间/min | |||
| 0.6mol•L-1H2C2O4溶液 | H2O | 0.2mol•L-1KMnO4溶液 | 3.0mol•L-1稀硫酸 | ||
| ① | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| ② | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
(2)请解释实验②中加入4.0mL蒸馏水的原因:
(3)据实验资料记载,Mn2+对该反应有催化作用。某小组同学计划设计实验验证Mn2+对该反应有催化作用,请填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 向试管中加入少量固体 | 室温下溶液颜色褪至色时所需时间/min | |||
| 0.6mol•L-1H2C2O4溶液 | H2O | 0.2mol•L-1KMnO4溶液 | 3.0mol•L-1稀硫酸 | |||
| ③ | 3.0 | t | ||||
您最近半年使用:0次
解题方法
3 . 关于反应A(g)+B(g) C(g) ΔH<0,下列说法中,正确的是
C(g) ΔH<0,下列说法中,正确的是
 C(g) ΔH<0,下列说法中,正确的是
C(g) ΔH<0,下列说法中,正确的是| A.一定是自发反应 |
| B.温度升高,化学反应速率加快 |
| C.反应物浓度增大,平衡向正反应方向移动 |
| D.催化剂不参与化学反应 |
您最近半年使用:0次
21-22高一·全国·假期作业
解题方法
4 . 请你解释下列现象。
(1)医用药品常在低温、干燥环境下密封保存_______ 。
(2)向一堆等火“鼓风”,可以使火势变强_______ 。
(3)微量的二氧化锰粉末可以使过氧化氢快速分解,而二氧化锰的质量在反应前后并没有发生改变_______ 。
(1)医用药品常在低温、干燥环境下密封保存
(2)向一堆等火“鼓风”,可以使火势变强
(3)微量的二氧化锰粉末可以使过氧化氢快速分解,而二氧化锰的质量在反应前后并没有发生改变
您最近半年使用:0次
解题方法
5 . 在一定体积的密闭容器中进行如下反应: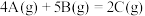
(1)开始时,A为 ,2s后,A为
,2s后,A为 。计算该反应的速率
。计算该反应的速率_______ 。
(2)请用适当的理论模型解释。
①温度升高,反应速率提高_______ 。
②使用催化剂,反应速率提高_______ 。
③增大A的浓度,反应速率提高_______ 。
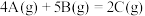
(1)开始时,A为
 ,2s后,A为
,2s后,A为 。计算该反应的速率
。计算该反应的速率(2)请用适当的理论模型解释。
①温度升高,反应速率提高
②使用催化剂,反应速率提高
③增大A的浓度,反应速率提高
您最近半年使用:0次
解题方法
6 . 某化学反应2A B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况见表,表中温度的单位为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况见表,表中温度的单位为摄氏度(℃)。
根据上述数据,回答下列问题。
(1)在实验1、2中,有一个实验使用了催化剂。请利用表中数据判断哪个实验使用了催化剂,并说明理由____ 。
(2)根据表中数据可知,实验3一定达到化学平衡状态的时间是____ 。
A.10min后 B.20min后 C.30min后
 B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况见表,表中温度的单位为摄氏度(℃)。
B+C在三种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况见表,表中温度的单位为摄氏度(℃)。| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
(1)在实验1、2中,有一个实验使用了催化剂。请利用表中数据判断哪个实验使用了催化剂,并说明理由
(2)根据表中数据可知,实验3一定达到化学平衡状态的时间是
A.10min后 B.20min后 C.30min后
您最近半年使用:0次
2022-11-26更新
|
138次组卷
|
2卷引用:2019版鲁科化学必修第二册第2章本章自我评价课后习题
解题方法
7 . 回答下列问题
(1) 的分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。实验测得70℃时,甲、乙两种条件下
的分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。实验测得70℃时,甲、乙两种条件下 浓度随时间的变化如下图所示:
浓度随时间的变化如下图所示:
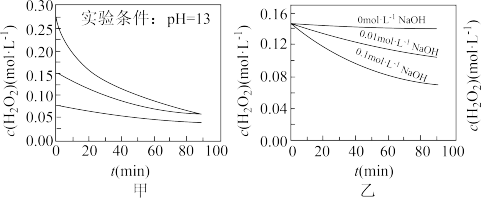
①图甲表明,_______ 条件相同时,_______ 越大, 分解速率越快。
分解速率越快。
②图乙表明,_______ 条件相同时,_______ 越大, 分解速率越快。
分解速率越快。
(2)对于 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组的同学设计了如图所示的实验。
分解的催化效果,研究小组的同学设计了如图所示的实验。

①可通过观察_______ ,比较得出结论。
②有同学提出将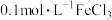 溶液改为
溶液改为 更为合理,其理由是
更为合理,其理由是_______ 。
(1)
 的分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。实验测得70℃时,甲、乙两种条件下
的分解速率受温度、浓度、催化剂以及溶液酸碱性等多种因素影响。实验测得70℃时,甲、乙两种条件下 浓度随时间的变化如下图所示:
浓度随时间的变化如下图所示:
①图甲表明,
 分解速率越快。
分解速率越快。②图乙表明,
 分解速率越快。
分解速率越快。(2)对于
 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组的同学设计了如图所示的实验。
分解的催化效果,研究小组的同学设计了如图所示的实验。
①可通过观察
②有同学提出将
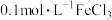 溶液改为
溶液改为 更为合理,其理由是
更为合理,其理由是
您最近半年使用:0次
8 . 硫酸工业生产中有如下反应:

请回答以下问题:
(1)为什么在生产中要使用过量的空气?______
(2)为什么要使用催化剂?______
(3)为什么无须在高压下进行反应?______


请回答以下问题:
(1)为什么在生产中要使用过量的空气?
(2)为什么要使用催化剂?
(3)为什么无须在高压下进行反应?
您最近半年使用:0次
9 . 请解释下列现象。
(1)夏季常把食物放在冰箱中冷藏_______ 。
(2)将大小相同的铁片分别放入相同体积的 和
和 盐酸中,后者产生氢气的速率比前者大
盐酸中,后者产生氢气的速率比前者大________ 。
(3)常温常压下合成氨反应的速率极小,工业上常采用的反应条件是约500℃、20~50MPa(约200~500个大气压)下用铁触媒作催化剂_______ 。
(1)夏季常把食物放在冰箱中冷藏
(2)将大小相同的铁片分别放入相同体积的
 和
和 盐酸中,后者产生氢气的速率比前者大
盐酸中,后者产生氢气的速率比前者大(3)常温常压下合成氨反应的速率极小,工业上常采用的反应条件是约500℃、20~50MPa(约200~500个大气压)下用铁触媒作催化剂
您最近半年使用:0次
2022-11-24更新
|
110次组卷
|
2卷引用:苏教2020版化学必修第二册专题6第一单元 化学反应速率与反应限度课后习题
名校
解题方法
10 . 某化学小组欲测定KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/L NaHSO3溶液,所得数据如图所示。
已知:ClO +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
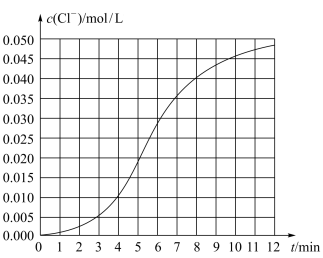
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=____ mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
①补全方案I中的实验操作:____ 。
②方案II中的假设为____ 。
③除I、II、III中的假设外,还可以提出的假设是____ 。
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:____ 。
ii.12min后,化学反应速率变慢的原因是_____ 。
已知:ClO
 +3HSO
+3HSO =Cl-+3SO
=Cl-+3SO +3H+。
+3H+。
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大,12min后逐渐变慢(12min后图略)。
i.小组同学针对这一现象进一步通过测定c(Cl-)随时间变化的曲线探究速率先增大的原因,具体如表所示。
| 方案 | 假设 | 实验操作 |
| I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,_____ |
| II | ____ | 取10mL0.1mol/L KClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液 |
| III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1mL水,向烧杯②中加入1mL0.2mol/L盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液 |
②方案II中的假设为
③除I、II、III中的假设外,还可以提出的假设是
④在已知方案I的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:
ii.12min后,化学反应速率变慢的原因是
您最近半年使用:0次
2022-06-18更新
|
437次组卷
|
12卷引用:【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题
【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题课时1 化学反应的速率——A学习区 夯实基础(人教版必修2)课时1 化学反应的速率——A学习区 夯实基础(人教版(2019)第二册)必修第二册RJ第6章第二节 化学反应的速率与限度 课时1人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 第一节 化学反应速率 课时2 影响化学反应速率的因素河南省洛阳市2020-2021学年高一下学期期中考试化学试题选择性必修1(SJ)专题2第一单元课时2 影响化学反应速率的因素河北省任丘一中2021-2022学年高二上学期阶段考试(一)化学试题贵州省“三新”改革联盟2021-2022学年高一下学期校联考等级考(四)化学试题北京海淀区八一学校2021-2022学年高一下学期6月月考化学试题2019版鲁科化学必修第二册第2章本章自我评价课后习题2.1.2影响化学反应速率的因素 课后



