1 . 空气中 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。
(1)利用高炉炼铁尾气中的 制取有机物的过程如下:
制取有机物的过程如下: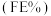 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: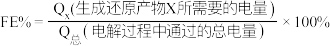 ,选择性
,选择性 .
.
“电解”在质子交换膜电解池中进行,生成 的电极反应式为
的电极反应式为____________ ,当电解电压为 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为____________ .
(2)利用铟氧化物催化 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,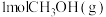 和
和 放出
放出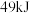 的热量,其热化学方程式为
的热量,其热化学方程式为____________ .
②若原料气中 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是____________ .
③制取 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者____________ 后者(选填“>”、“=”或“<”);保持气体流速不变,反应管内温度从 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是____________ .
 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)利用高炉炼铁尾气中的
 制取有机物的过程如下:
制取有机物的过程如下: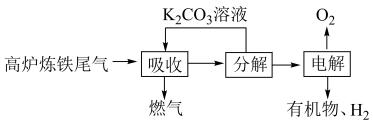
 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: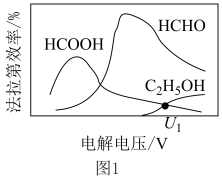
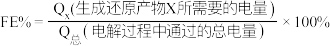 ,选择性
,选择性 .
.“电解”在质子交换膜电解池中进行,生成
 的电极反应式为
的电极反应式为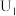 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为(2)利用铟氧化物催化
 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,
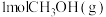 和
和 放出
放出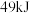 的热量,其热化学方程式为
的热量,其热化学方程式为②若原料气中
 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是③制取
 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是
您最近半年使用:0次
2 . 精脱硫技术主要用于煤气中羰基硫(COS)和二硫化碳(CS2)的转化。回答下列问题:
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:___________ (填“I”或“Ⅱ”)。
②反应 的△H=
的△H=___________ kJ·mol-1。
(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:___________ (填“3.4%Mo”或“8.7%Mo”)作催化剂效果最好;当H2S选择性低于100%时表明部分COS气体与催化剂发生了反应,催化剂有吸硫现象,若H2S选择性高于100%,可能的原因是___________ 。
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为___________ ,设晶体密度为ρg·cm3,则晶胞参数为___________ pm(阿伏加德罗常数的值为NA)。 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。
①0-250min内,H2分压的平均变化值为___________ kPa·min-l。
②该温度下,平衡常数Kp=___________ (kPa)-2(列出计算式)。
(1)利用焦炉煤气中的H2可脱除煤气中羰基硫(COS)。羰基硫氢化反应历程有途径I和途径Ⅱ两种可能,如图所示:
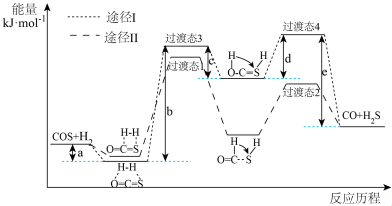
②反应
 的△H=
的△H=(2)MoS2可作羰基硫氢化反应的催化剂,催化机理如图所示:
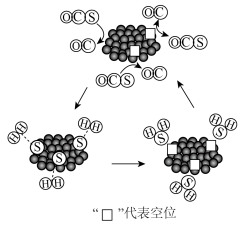
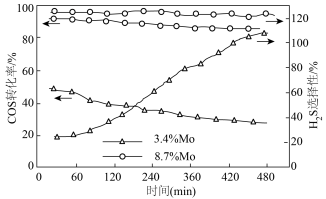
(3)金属Mo的晶胞如图所示,若原子a、b的坐标分别为(0,0,0)、(1,0,0),则原子c的坐标为

 ,容器内气体压强随时间变化如下表所示。
,容器内气体压强随时间变化如下表所示。| 时间/min | 0 | 50 | 100 | 150 | 200 | 250 | 300 |
| 压强/kPa | 100 | 88.0 | 79.8 | 72.4 | 68.2 | 65.0 | 65.0 |
②该温度下,平衡常数Kp=
您最近半年使用:0次
名校
3 . 有机反应中经常采用实验和量子学手段进行反应的微观探究。一种铜催化某有机反应历程如下,下列说法错误的是

| A.碘元素位于周期表p区 |
| B.催化剂可降低该反应的活化能,加快反应速率 |
| C.Tpy-[CuⅡ]CN-是中间产物 |
D.总反应方程式是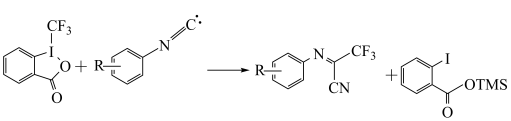 |
您最近半年使用:0次
名校
4 . 研究 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
I.
II.
(1)一定条件下,速率常数与活化能、温度的关系式为 (R、C为常数,k为速率常数,
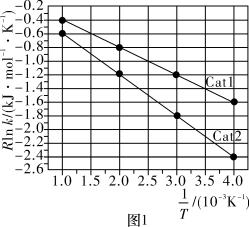
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
在Cat2作用下,该反应的活化能 为
为___________  ;催化效果更好的是
;催化效果更好的是___________ (填“Cat1”或“Cat2”)。
(2) 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
若反应I、II均达到平衡时, ;则表中
;则表中
___________ ; 内,
内, 的分压变化率为
的分压变化率为___________  ;反应I的平衡常数
;反应I的平衡常数
___________  。
。
(3) 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:
主反应:
副反应:

若将 和
和 按体积比为
按体积比为 混合(
混合(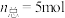 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
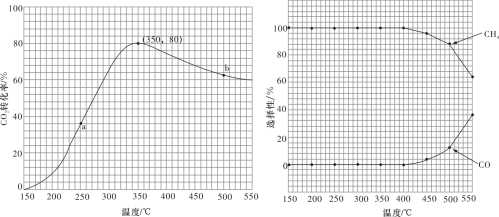
①a点的正反应速率和逆反应速率的大小关系为
___________ (填“>”“=”或“<”) 。
。
②催化剂在较低温度时主要选择___________ (填“主反应”或“副反应”)。
③350~400℃时; 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是___________ 。
 资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:
资源的综合利用,对实现“碳达峰”和“碳中和”有重要意义。已知:I.

II.

(1)一定条件下,速率常数与活化能、温度的关系式为
 (R、C为常数,k为速率常数,
(R、C为常数,k为速率常数, 为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。
为活化能,T为温度)。一定温度下,反应Ⅰ的速率常数在不同催化剂(Cat1、Cat2)作用下,与温度的关系如图1所示。在Cat2作用下,该反应的活化能
 为
为 ;催化效果更好的是
;催化效果更好的是
(2)
 在
在 催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的
催化下,同时发生反应I、II;此方法是解决温室效应和能源短缺问题的重要手段。保持温度T时,在容积不变的密闭容器中,充入一定量的 及
及 ;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:
;起始及达到平衡时(tmin时恰好达到平衡),容器内各气体物质的量及总压强如下表:| 物质的量/mol | 总压强/kPa | |||||
 |  |  | CO |  | ||
| 起始 | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡 | n | 0.3 | p | |||
 ;则表中
;则表中
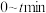 内,
内, 的分压变化率为
的分压变化率为 ;反应I的平衡常数
;反应I的平衡常数
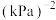 。
。(3)
 催化加氢制甲烷涉及的反应主要有:
催化加氢制甲烷涉及的反应主要有:主反应:

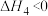
副反应:


若将
 和
和 按体积比为
按体积比为 混合(
混合(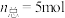 ),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间,
),匀速通入装有催化剂的反应容器中,发生上述反应(包括主反应和副反应)。反应相同时间, 转化率、
转化率、 和CO选择性随温度变化的曲线分别如图所示。
和CO选择性随温度变化的曲线分别如图所示。
①a点的正反应速率和逆反应速率的大小关系为

 。
。②催化剂在较低温度时主要选择
③350~400℃时;
 转化率呈现减小的变化趋势,其原因是
转化率呈现减小的变化趋势,其原因是
您最近半年使用:0次
解题方法
5 . 实验小组探究Cu和 溶液的反应原理。
溶液的反应原理。
(1)配制溶液
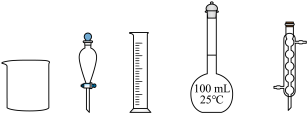
用 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有_______ (填名称)。
(2)测定 溶液的pH
溶液的pH
用_______ (填仪器名称)测得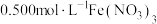 溶液的pH为1.10。
溶液的pH为1.10。
(3)提出假设
假设ⅰ:_______ ,反应的离子方程式为:
假设ⅱ: 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向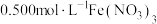 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加_______ (填化学式)溶液,观察到_______ 的实验现象,证明了反应中有 生成。
生成。
实验Ⅱ:向pH=1.10的_______ (填化学式)溶液中加入过量铜粉并充分振荡,无明显现象。
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设_______ (填“ⅰ”或“ⅱ”)成立。
(5)查阅资料知,铜粉与 溶液可能涉及的反应有;
溶液可能涉及的反应有;
反应①: ;
;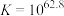 ;速率很慢。
;速率很慢。
反应②: ;
;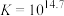 ,速率较快。
,速率较快。
反应③: ;
;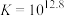 ;速率很快。
;速率很快。
反应④: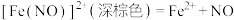
(a)对反应①来说, 起到的作用为
起到的作用为_______ ;为验证这一作用,设计的实验方案为_______ 。
(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到 的存在,原因是
的存在,原因是_______ 。
 溶液的反应原理。
溶液的反应原理。(1)配制溶液
用
 标准试剂配制
标准试剂配制 溶液,下列仪器中无需使用的有
溶液,下列仪器中无需使用的有
(2)测定
 溶液的pH
溶液的pH用
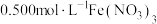 溶液的pH为1.10。
溶液的pH为1.10。(3)提出假设
假设ⅰ:

假设ⅱ:
 将Cu氧化,反应的离子方程式为:
将Cu氧化,反应的离子方程式为:
(4)实验探究
实验Ⅰ:向
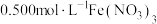 溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加
溶液中加入过量铜粉并充分振荡,溶液变成深棕色,无气泡产生。实验小组取少量上层清液于另一洁净试管中,往其中滴加 生成。
生成。实验Ⅱ:向pH=1.10的
探究结论:综合“实验Ⅰ”和“实验Ⅱ”可知,假设
(5)查阅资料知,铜粉与
 溶液可能涉及的反应有;
溶液可能涉及的反应有;反应①:
 ;
;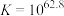 ;速率很慢。
;速率很慢。反应②:
 ;
;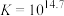 ,速率较快。
,速率较快。反应③:
 ;
;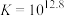 ;速率很快。
;速率很快。反应④:
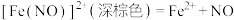
(a)对反应①来说,
 起到的作用为
起到的作用为(b)“实验Ⅰ”反应中无论Cu过量多少,始终都能检测到
 的存在,原因是
的存在,原因是
您最近半年使用:0次
名校
解题方法
6 . 利用1-甲基萘(1-MN)制备四氢萘类物质(MTLs,包括1-MTL和5-MTL)。
反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
(1)1-甲基萘(1-MN)中的大Π键可表示为______ ,提高 反应选择性的关键因素是
反应选择性的关键因素是______ 。
(2)已知一定条件下反应 、
、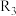 、
、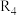 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
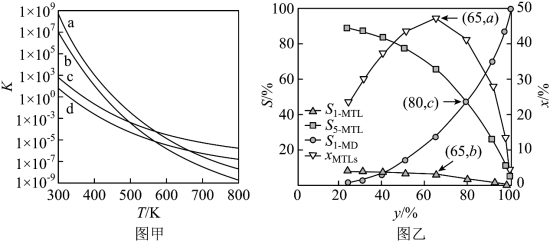
(3)四个平衡体系的平衡常数与温度的关系如图甲所示。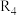 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应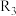 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为______ 。
②已知反应 的速率方程
的速率方程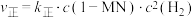 ,
,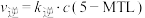 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③下列说法正确的是______ (填标号)。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.由上述信息可知,400K时反应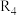 速率最快
速率最快
D.反应体系中1-MD最稳定.
(4)1-MN在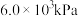 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性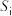 (某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数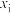 (
(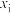 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
______  (列出计算式)。
(列出计算式)。
反应过程中伴有生成十氢萘(1-MD)的副反应,涉及反应如图:
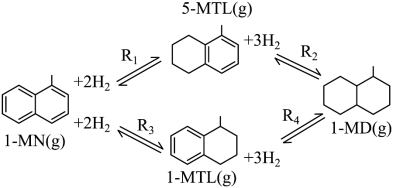
(1)1-甲基萘(1-MN)中的大Π键可表示为
 反应选择性的关键因素是
反应选择性的关键因素是(2)已知一定条件下反应
 、
、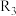 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(3)四个平衡体系的平衡常数与温度的关系如图甲所示。
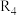 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应 的平衡常数随温度变化的曲线为
的平衡常数随温度变化的曲线为②已知反应
 的速率方程
的速率方程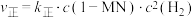 ,
,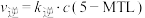 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关)。温度
分别为正、逆反应速率常数,只与温度、催化剂有关)。温度 下反应达到平衡时
下反应达到平衡时 ,温度
,温度 下反应达到平衡时
下反应达到平衡时 。由此推知,
。由此推知,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③下列说法正确的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.由上述信息可知,400K时反应
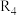 速率最快
速率最快D.反应体系中1-MD最稳定.
(4)1-MN在
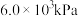 的高压
的高压 氛围下反应(
氛围下反应( 压强近似等于总压)。不同温度下达平衡时各产物的选择性
压强近似等于总压)。不同温度下达平衡时各产物的选择性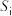 (某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数
(某生成物i的物质的量与消耗l-MN的物质的量之比)和物质的量分数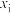 (
(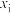 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应
外其他各物种总物质的量之比)随1-MN平衡转化率y的变化关系如图乙所示,y为65%时反应 的平衡常数
的平衡常数
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
2024-02-29更新
|
543次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2023-2024学年高三一模化学试题
黑龙江省哈尔滨市第三中学校2023-2024学年高三一模化学试题福建省福州市福建师范大学附属中学2024届高三一模化学试题(已下线)大题04 化学反应原理综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
解题方法
7 . 某装置中模拟 捕获和转化,先进行反应①
捕获和转化,先进行反应①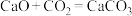 ,反应完毕后向装置中以恒定流速通入恒定组成的
,反应完毕后向装置中以恒定流速通入恒定组成的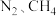 混合气,进行反应②
混合气,进行反应② ,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到
,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到 。下列说法错误的是
。下列说法错误的是
 捕获和转化,先进行反应①
捕获和转化,先进行反应①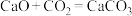 ,反应完毕后向装置中以恒定流速通入恒定组成的
,反应完毕后向装置中以恒定流速通入恒定组成的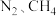 混合气,进行反应②
混合气,进行反应② ,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到
,单位时间流出气体各组分的物质的量随反应时间变化如图所示。第二阶段反应中始终未检测到 。下列说法错误的是
。下列说法错误的是
A. 后催化剂催化效果逐渐降低 后催化剂催化效果逐渐降低 |
B.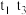 ,存在生成 ,存在生成 的副反应 的副反应 |
C. 时催化剂上开始积碳 时催化剂上开始积碳 |
D. 时,副反应生成 时,副反应生成 的速率小于反应②生成 的速率小于反应②生成 速率 速率 |
您最近半年使用:0次
2024-02-04更新
|
142次组卷
|
2卷引用:山东省东营市2023-2024学年高二期末考试化学试题
8 . 采取高效经济方式利用 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
Ⅰ.

Ⅱ.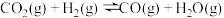
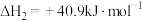
回答以下问题:
(1)已知: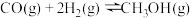
 ,则反应Ⅰ的
,则反应Ⅰ的
___________  。
。
(2)有利于提高 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。
(3)在催化剂作用下,测得 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)

① 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为___________ 。
②510K时,往恒容密闭容器中按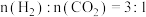 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内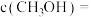
 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
___________ (列计算式即可)。
(4) 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
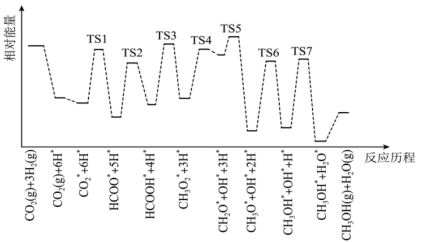
①气体在催化剂表面的吸附是___________ (填“吸热”或“放热”)过程。
②该反应历程中反应速率最快步骤的化学方程式为___________ 。
(5)甲醇催化制取丙烯( )的过程中发生如下反应:
)的过程中发生如下反应:
Ⅰ.
Ⅱ.
反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为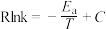 (
( 为活化能,
为活化能, 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是___________ 。

 对人类社会发展具有重要意义。以
对人类社会发展具有重要意义。以 和
和 为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):
为原料合成甲醇主要发生反应Ⅰ和反应Ⅱ(不考虑其他反应):Ⅰ.


Ⅱ.
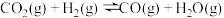
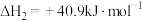
回答以下问题:
(1)已知:
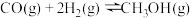
 ,则反应Ⅰ的
,则反应Ⅰ的
 。
。(2)有利于提高
 平衡转化率的措施有___________(填标号)。
平衡转化率的措施有___________(填标号)。A.增大 投料比 投料比 | B.增大压强 |
| C.使用高效催化剂 | D.及时将 分离 分离 |
 平衡转化率(曲线Y)和平衡时
平衡转化率(曲线Y)和平衡时 的选择性(曲线X)随温度变化如图所示。(已知:
的选择性(曲线X)随温度变化如图所示。(已知: 的选择性
的选择性 )
)
①
 加氢制
加氢制 时,温度选择
时,温度选择 的原因为
的原因为②510K时,往恒容密闭容器中按
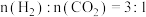 充入
充入 和
和 ,若平衡时容器内
,若平衡时容器内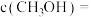
 ,则反应Ⅰ的平衡常数
,则反应Ⅰ的平衡常数
(4)
 和
和 在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
在某催化剂表面合成甲醇(反应Ⅰ)的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注,“TS”表示过渡状态。
①气体在催化剂表面的吸附是
②该反应历程中反应速率最快步骤的化学方程式为
(5)甲醇催化制取丙烯(
 )的过程中发生如下反应:
)的过程中发生如下反应:Ⅰ.

Ⅱ.

反应Ⅰ的Arrhenius经验公式的实验数据如图所示,已知Arrhenius经验公式为
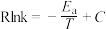 (
( 为活化能,
为活化能, 为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
为速率常数,R和C为常数)。当改变外界条件时,实验数据由图中直线a变为直线b,则实验可能改变的外界条件是
您最近半年使用:0次
解题方法
9 . 工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
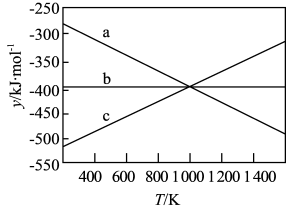
(1)在 和
和 的反应体系中:
的反应体系中:
反应1: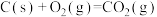
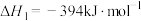
反应2: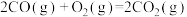
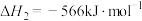
①反应3: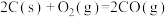
 =
=___________  。
。
②设 ,反应1、2和3的
,反应1、2和3的 随温度的变化关系如上图所示。图中对应于反应2的线条是
随温度的变化关系如上图所示。图中对应于反应2的线条是___________ 。
③一定压强下,随着温度的升高,气体中 与
与 的物质的量之比
的物质的量之比___________ (选填“增大”“减小”“不变”“无法判断”)。
(2)水煤气反应: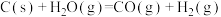
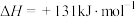 。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是___________ 。
(3)一氧化碳变换反应: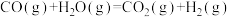
 。
。
①一定温度下,向恒容密闭容器中通入1.0mol 和1.0mol
和1.0mol ,压强为2KPa.反应达到平衡后测得
,压强为2KPa.反应达到平衡后测得 的物质的量为0.75mol,则反应的压强平衡常数为
的物质的量为0.75mol,则反应的压强平衡常数为___________ 。
②维持与题①相同的温度和总压,提高水蒸气的比例,使 的平衡转化率提高到90%,则原料气中水蒸气和
的平衡转化率提高到90%,则原料气中水蒸气和 的物质的量之比为
的物质的量之比为___________ 。
③生产过程中,为了提高变换反应的速率,下列措施中合适的是___________ 。
A.反应温度越高越好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,能量-反应过程如图所示。该催化反应反应机理:
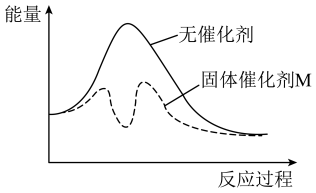
步骤Ⅰ: ;步骤Ⅱ:
;步骤Ⅱ:___________ 。

(1)在
 和
和 的反应体系中:
的反应体系中:反应1:
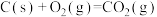
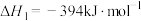
反应2:
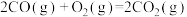
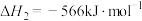
①反应3:
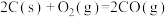
 =
= 。
。②设
 ,反应1、2和3的
,反应1、2和3的 随温度的变化关系如上图所示。图中对应于反应2的线条是
随温度的变化关系如上图所示。图中对应于反应2的线条是③一定压强下,随着温度的升高,气体中
 与
与 的物质的量之比
的物质的量之比(2)水煤气反应:
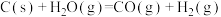
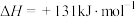 。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是
。工业生产水煤气时,通常交替通入合适量的空气和水蒸气与煤炭反应,其理由是(3)一氧化碳变换反应:
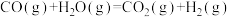
 。
。①一定温度下,向恒容密闭容器中通入1.0mol
 和1.0mol
和1.0mol ,压强为2KPa.反应达到平衡后测得
,压强为2KPa.反应达到平衡后测得 的物质的量为0.75mol,则反应的压强平衡常数为
的物质的量为0.75mol,则反应的压强平衡常数为②维持与题①相同的温度和总压,提高水蒸气的比例,使
 的平衡转化率提高到90%,则原料气中水蒸气和
的平衡转化率提高到90%,则原料气中水蒸气和 的物质的量之比为
的物质的量之比为③生产过程中,为了提高变换反应的速率,下列措施中合适的是
A.反应温度越高越好 B.适当提高反应物压强
C.选择合适的催化剂 D.通入一定量的氮气
④以固体催化剂M催化变换反应,能量-反应过程如图所示。该催化反应反应机理:

步骤Ⅰ:
 ;步骤Ⅱ:
;步骤Ⅱ:
您最近半年使用:0次
名校
解题方法
10 .  催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为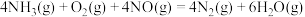

(1)催化剂___________ 改变ΔH(填“能”或“不能”)
(2)催化剂的制备。将预先制备的一定量的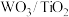 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为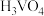 沉淀的离子方程式为
沉淀的离子方程式为___________ ;
(3)催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
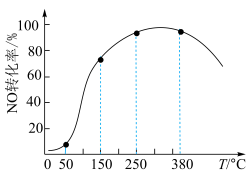
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:___________
(4)废催化剂的回收。回收 催化剂并制备
催化剂并制备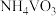 的过程可表示为
的过程可表示为

①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
②向pH=8的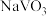 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知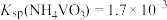 ,加过量
,加过量 溶液的目的是
溶液的目的是___________ 。
(5)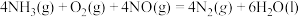 ΔH
ΔH___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
 催化剂能催化
催化剂能催化 脱除烟气中的NO,反应为
脱除烟气中的NO,反应为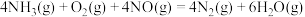

(1)催化剂
(2)催化剂的制备。将预先制备的一定量的
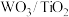 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发焙烧等工序得到颗粒状
溶液,经蒸发焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为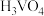 沉淀的离子方程式为
沉淀的离子方程式为(3)催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为
催化剂的反应器,测得NO的转化率随温度的变化如题图所示。反应温度在50~150℃范围内,NO转化为 的转化率迅速上升,原因是:
的转化率迅速上升,原因是:
(4)废催化剂的回收。回收
 催化剂并制备
催化剂并制备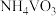 的过程可表示为
的过程可表示为
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
②向pH=8的
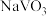 溶液中加入过量的
溶液中加入过量的 溶液,生成
溶液,生成 沉淀。已知
沉淀。已知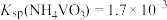 ,加过量
,加过量 溶液的目的是
溶液的目的是(5)
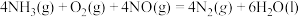 ΔH
ΔH (填“>”“<”或“=”)
(填“>”“<”或“=”)
您最近半年使用:0次



