名校
解题方法
1 . 铁的配合物离子催化某反应的一种反应机理和相对能量的变化情况如图所示
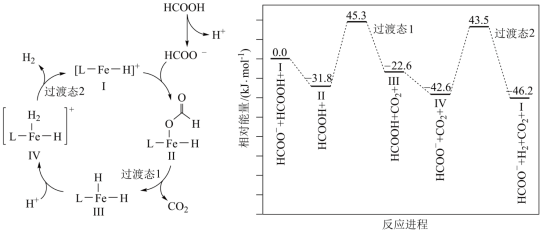
| A.总反应速率由Ⅳ→Ⅰ决定 |
B. 浓度过大会导致反应Ⅰ→Ⅱ速率加快 浓度过大会导致反应Ⅰ→Ⅱ速率加快 |
| C.该过程中铁的配合物离子催化剂不能提高平衡转化率 |
D.总反应为 |
您最近一年使用:0次
2023-07-05更新
|
370次组卷
|
3卷引用:湖南省怀化市2022-2023学年高二下学期期末考试化学试题
解题方法
2 . 某些物质间的转化关系如图所示。下列说法错误的是
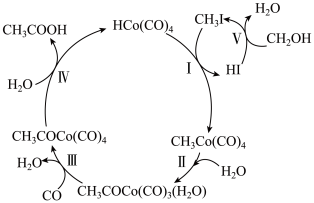

| A.该转化关系的总反应原子利用率为100% |
B.HI、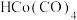 是该转化过程中的催化剂 是该转化过程中的催化剂 |
| C.Ⅳ的反应类型为取代反应 |
| D.转化过程中有非极性键的断裂和生成 |
您最近一年使用:0次
名校
解题方法
3 . 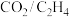 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是

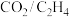 耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
耦合反应制备丙烯酸甲酯的机理如图所示。下列叙述错误的是
| A.由步骤①②知:加成反应也可生成酯类物质 |
| B.反应过程中存在C-H键的断裂 |
| C.该反应的原子利用率为100% |
D.若将步骤②中 换为 换为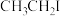 ,则产品将变为丙烯酸乙酯 ,则产品将变为丙烯酸乙酯 |
您最近一年使用:0次
2023-05-04更新
|
467次组卷
|
4卷引用:湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题
湖南省长沙市浏阳市2022-2023学年高二下学期期末考试化学试题福建省福州第一中学2022-2023学年高二下学期期末考试化学试题福建省厦门第一中学2023届高三下学期第三次模拟测试化学试题(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
4 . TiO2可以催化分解CO2实现碳元素的循环利用,其催化反应机理如图。下列说法错误的是
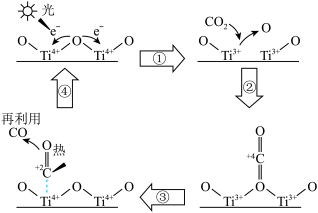

| A.过程①中TiO2发生了还原反应 |
| B.使用TiO2催化剂可以大大降低CO2分解的反应热 |
| C.该反应消耗了光能和热能 |
| D.该反应过程产生的O原子可能结合成O2 |
您最近一年使用:0次
名校
5 . 如图所示为工业合成氨的流程图。下列有关说法不正确的是
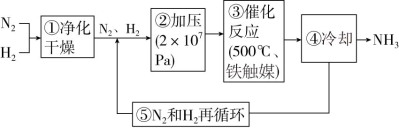

| A.步骤①中“净化”的目的是防止催化剂中毒 |
| B.步骤②中“加压”既可提高原料的转化率,又可加快反应速率 |
| C.步骤③中“500℃、铁触媒”有利于提高原料的平衡转化率 |
| D.步骤④中“冷却”的目的是将氨液化分离出来,提高原料的转化率 |
您最近一年使用:0次
2023-02-19更新
|
178次组卷
|
3卷引用:湖南省永州市2022-2023学年高二上学期期末考试化学试题
湖南省永州市2022-2023学年高二上学期期末考试化学试题(已下线)第08讲 化学反应的调控-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)河南省宜阳县第一高级中学2023-2024学年高二上学期9月开学考试化学试题
6 . 理论研究表明,在101 和298K下,
和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是
异构化反应过程的能量变化如图所示。下列说法错误的是
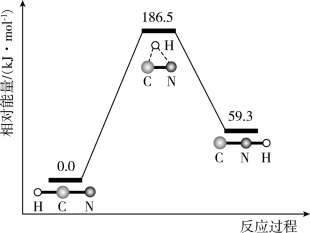
 和298K下,
和298K下, 异构化反应过程的能量变化如图所示。下列说法错误的是
异构化反应过程的能量变化如图所示。下列说法错误的是
A. 比 比 稳定 稳定 | B.使用催化剂,可以改变反应的反应热 |
| C.正反应的活化能大于逆反应的活化能 | D.该异构化反应的 |
您最近一年使用:0次
2023-02-15更新
|
110次组卷
|
2卷引用:湖南省邵阳市新邵县第八中学2022-2023学年高二上学期期末质量检测化学试题
7 . 工业合成氨反应包含多个基元反应,其反应机理如图所示。下列说法错误的是
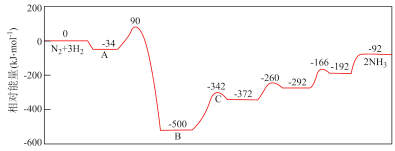

| A.从充入反应物到A处,表示N2、H2在催化剂表面吸附放热 |
| B.该历程中最大活化能E正=590kJ•mol-1 |
| C.工业合成氨温度为700K左右,主要考虑催化剂在此温度下活性较高 |
| D.催化剂可以降低活化能,从而显著提高反应速率 |
您最近一年使用:0次
2023-02-14更新
|
149次组卷
|
2卷引用:湖南省娄底市涟源市2023-2024学年高二上学期1月期末考试化学试题
解题方法
8 . 某化学兴趣小组为了探究催化剂对H2O2分解速率的影响,进行了一系列实验,请回答相关问题。
(1)将0.10molMnO2粉末加入到40mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。
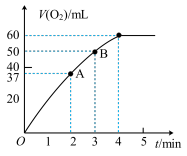
①该实验放出气体的总体积是_______ mL。
②A、B两点反应速率较慢的为_______ 点,理由是_______ 。
③H2O2的初始物质的量浓度是_______ (保留两位有效数字)。
(2)已知:Fe3+和Cu2+也能作为H2O2分解的催化剂,为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下图甲、乙所示的实验。
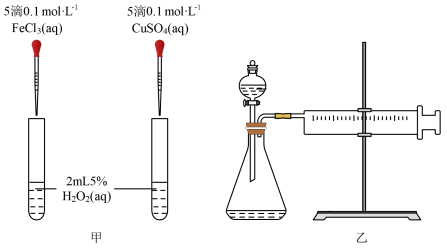
①定性分析:如图甲可通过观察_______ ,定性比较得出结论。小红认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
②定量分析:如图乙所示,实验时均以生成40mL气体为标准,其它可能影响实验的因素均忽略。实验中需要测量的数据是_______ 。
(1)将0.10molMnO2粉末加入到40mLH2O2溶液中,在标准状况下放出气体的体积和时间的关系如右图所示。

①该实验放出气体的总体积是
②A、B两点反应速率较慢的为
③H2O2的初始物质的量浓度是
(2)已知:Fe3+和Cu2+也能作为H2O2分解的催化剂,为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下图甲、乙所示的实验。

①定性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时均以生成40mL气体为标准,其它可能影响实验的因素均忽略。实验中需要测量的数据是
您最近一年使用:0次
解题方法
9 . 在恒容密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
 2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是
2SO3(g) ΔH<0,其速率-时间图像如下,则t1时刻改变的条件可能是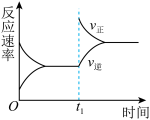
| A.升高温度 | B.加入催化剂 |
| C.充入一定量的氧气 | D.充入一定量的氦气 |
您最近一年使用:0次
2023-02-13更新
|
833次组卷
|
5卷引用:湖南省益阳市2020-2021学年高二上学期期末考试化学试题
湖南省益阳市2020-2021学年高二上学期期末考试化学试题【精品卷】2.1.2 影响化学反应速率的因素课堂例题-人教版2023-2024学年选择性必修1(已下线)专题一 化学反应速率图象(讲)(已下线)题型12 化学平衡图表分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)(已下线)提升练04 化学平衡图像分析-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
名校
10 . 随着经济的发展,能源与环境问题越来越受到人们的重视和关注,资源利用和环境保护是当前重要研究课题,回答下列问题:
(1)合成气( 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
则反应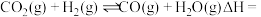
_______  (用含a、b代数式表示),
(用含a、b代数式表示),
_______ 0(填“>”或“<”)。
(2)科学家提出利用 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示:
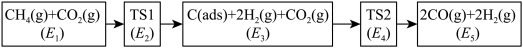
注: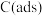 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。
若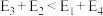 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为_______ 。
(3)一定条件下,向密闭容器中通入一定量的 和
和 制备甲醇,投料比
制备甲醇,投料比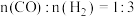 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
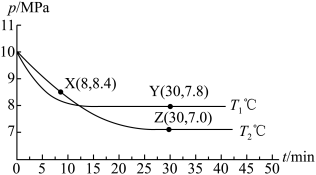
①X点的逆反应速率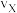 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率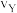 (正)的大小关系:
(正)的大小关系: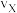 (逆)
(逆)_______ 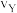 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。
②图中Z点的压强平衡常数
_______ 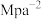 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)利用电化学方法通过微生物电催化将 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
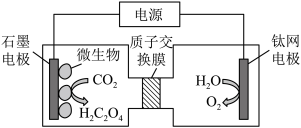
阴极区电极反应式为_______ ;当体系的温度升高到一定程度,电极反应的速率反而迅速下降,其主要原因是_______ 。装置工作时,阴极区除生成 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为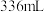 时,测得左池
时,测得左池 的物质的量为
的物质的量为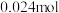 ,则电解效率为
,则电解效率为_______ 。
(1)合成气(
 、
、 、
、 )在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:
)在工业上可用来生产甲醇,有关反应的热化学方程式及不同温度下的化学平衡常数如表所示:| 热化学方程式 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
Ⅰ.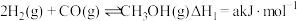 |  | 2.50 | 0.340 | 0.150 |
Ⅱ.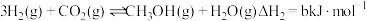 |  | 2.50 | 0.578 | 0.378 |
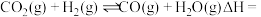
 (用含a、b代数式表示),
(用含a、b代数式表示),
(2)科学家提出利用
 与
与 制备“合成气”(
制备“合成气”( 、
、 ),可能的反应历程如下图所示:
),可能的反应历程如下图所示: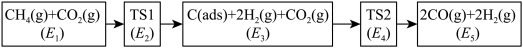
注:
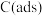 表示吸附性活性炭,E表示相对总能量,
表示吸附性活性炭,E表示相对总能量, 表示过渡态。
表示过渡态。若
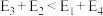 则决定制备“合成气”反应速率的化学方程式为
则决定制备“合成气”反应速率的化学方程式为(3)一定条件下,向密闭容器中通入一定量的
 和
和 制备甲醇,投料比
制备甲醇,投料比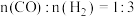 ,反应为
,反应为 ;测得容器内总压强与反应时间的关系如下图所示。
;测得容器内总压强与反应时间的关系如下图所示。
①X点的逆反应速率
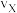 (逆)与Y点的正反应速率
(逆)与Y点的正反应速率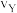 (正)的大小关系:
(正)的大小关系: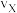 (逆)
(逆)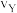 (正)(填“>”、“<”或“=”)。
(正)(填“>”、“<”或“=”)。②图中Z点的压强平衡常数

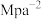 (保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(4)利用电化学方法通过微生物电催化将
 有效地转化为
有效地转化为 ,装置如图所示。
,装置如图所示。
阴极区电极反应式为
 外,还可能生成副产物并降低电解效率。已知:电解效率
外,还可能生成副产物并降低电解效率。已知:电解效率 ,标准状况下,当右池生成氧气体积为
,标准状况下,当右池生成氧气体积为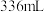 时,测得左池
时,测得左池 的物质的量为
的物质的量为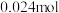 ,则电解效率为
,则电解效率为
您最近一年使用:0次
2023-02-11更新
|
112次组卷
|
2卷引用:湖南省怀化市2022-2023学年高二上学期期末考试化学试题



