名校
1 . 利用下列实验装置(部分夹持装置略)进行实验,能达到目的的是
A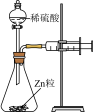 B
B 
C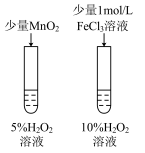 D
D 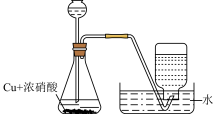
A
 B
B 
C
 D
D 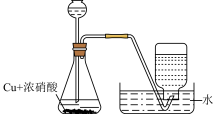
| A.利用针筒活塞向右移动,证明反应放热 | B.测定酸碱中和反应的反应热 |
| C.验证不同催化剂对化学反应速率的影响 | D.制备并收集 NO2 |
您最近一年使用:0次
2023-08-26更新
|
411次组卷
|
3卷引用:湖北省新高考联盟2023-2024学年高二上学期8月开学联考化学试题
名校
解题方法
2 . 已知反应2NO + 2H2 = N2 + 2H2O的速率方程为υ= kc2(NO)· c(H2)(k为速率常数),其反应历程如下:
① 2NO + H2 → N2+H2O2 慢 ; ② H2O2 + H2 → 2H2O 快
下列说法不正确 的是
① 2NO + H2 → N2+H2O2 慢 ; ② H2O2 + H2 → 2H2O 快
下列说法
| A.升高温度,可提高反应①、②的反应速率 |
| B.c (NO) 、c(H2)增大相同的倍数,对总反应的反应速率的影响程度相同 |
| C.该反应的快慢主要取决于反应① |
| D.可逆反应使用催化剂加快反应速率时,正逆反应的活化能均减小 |
您最近一年使用:0次
名校
解题方法
3 . 某实验小组用如下实验测定海带预处理后所得溶液的碘含量,实验步骤及现象如下:
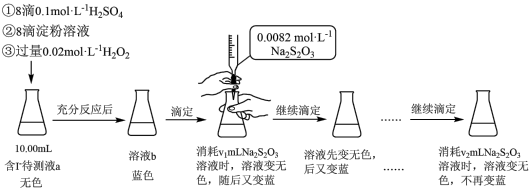
已知: ,下列说法不正确的是:
,下列说法不正确的是:

已知:
 ,下列说法不正确的是:
,下列说法不正确的是:| A.淀粉溶液为该反应的指示剂 |
B.溶液b为蓝色是因为发生了反应: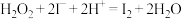 |
C.溶液反复由无色变蓝的原因可能是H2O2氧化 的反应速率比 的反应速率比 还原 还原 的反应速率快 的反应速率快 |
| D.上述实验不能准确测定待测液中的碘含量,应补充实验步骤:滴定前向溶液b中加少量MnO2,反应至不再产生气泡,过滤,对滤液进行滴定 |
您最近一年使用:0次
名校
4 . 某化学反应 在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(
在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:
下列说法不正确的是
 在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(
在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表: |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
A.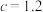 | B.实验2可能使用了催化剂 |
| C.正反应是吸热反应 | D.50~60分钟内,实验4的平均反应速率比实验3的大 |
您最近一年使用:0次
2023-11-28更新
|
74次组卷
|
2卷引用:湖北省鄂东南省级师范高中教育教学改革联盟学校2023-2024学年高二上学期期中联考化学试题
名校
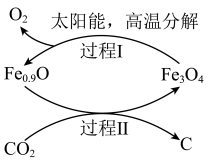
5 . 利用缺铁氧化物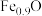 可实现
可实现 的综合利用,构建低碳环保社会,下列说法错误的是
的综合利用,构建低碳环保社会,下列说法错误的是
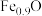 可实现
可实现 的综合利用,构建低碳环保社会,下列说法错误的是
的综合利用,构建低碳环保社会,下列说法错误的是
A.过程Ⅰ发生反应的化学方程式为 |
B.过程Ⅱ中 是氧化产物 是氧化产物 |
| C.在整个过程中Fe0.9O是催化剂 |
D.整个过程的总反应为 |
您最近一年使用:0次
2023-10-26更新
|
195次组卷
|
2卷引用:湖北省襄阳市第六中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
6 . 我国科学家最近开发新催化剂(P/Cu SAS@ CN)高效电还原 制备
制备 ,化学原理是
,化学原理是
 ,下列说法错误的是
,下列说法错误的是
 制备
制备 ,化学原理是
,化学原理是
 ,下列说法错误的是
,下列说法错误的是| A.P/Cu SAS@ CN能降低该反应的活化能 |
B.当 的消耗速率与 的消耗速率与 的生成速率之比等于2:7时,反应已达平衡 的生成速率之比等于2:7时,反应已达平衡 |
C.当水蒸汽浓度为 浓度的2倍时,反应已达平衡状态 浓度的2倍时,反应已达平衡状态 |
| D.该反应在低温下能自发进行 |
您最近一年使用:0次
2024-01-11更新
|
180次组卷
|
4卷引用:湖北省武汉市重点中学5G联合体2023-2024学年高二上学期期中考试化学试题
解题方法
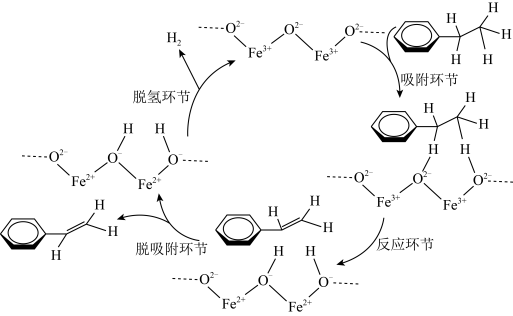
7 . 在催化剂 作用下,乙苯可脱氢制得苯乙烯,反应机理如图所示,“吸附环节”窗中乙苯分子被吸附在催化剂
作用下,乙苯可脱氢制得苯乙烯,反应机理如图所示,“吸附环节”窗中乙苯分子被吸附在催化剂 表面活性位点并被活化,下列说法
表面活性位点并被活化,下列说法错误 的是
 作用下,乙苯可脱氢制得苯乙烯,反应机理如图所示,“吸附环节”窗中乙苯分子被吸附在催化剂
作用下,乙苯可脱氢制得苯乙烯,反应机理如图所示,“吸附环节”窗中乙苯分子被吸附在催化剂 表面活性位点并被活化,下列说法
表面活性位点并被活化,下列说法
A.改变 颗粒大小会影响反应速率 颗粒大小会影响反应速率 |
| B.该环节中,温度较低时,更有利于发生的过程是“吸附环节” |
C. 降低乙苯脱氢反应的活化能,提高了乙苯平衡转化率 降低乙苯脱氢反应的活化能,提高了乙苯平衡转化率 |
D.该催化剂在使用过程中,失活现象比较严重,由此推断“脱氢环节”除了产生 ,还可能生成 ,还可能生成 离开催化剂表面 离开催化剂表面 |
您最近一年使用:0次
8 .  芳基羟胺在强酸水溶液作用下重排为氨基部分的反应机理如图:
芳基羟胺在强酸水溶液作用下重排为氨基部分的反应机理如图:

下列说法错误的是
 芳基羟胺在强酸水溶液作用下重排为氨基部分的反应机理如图:
芳基羟胺在强酸水溶液作用下重排为氨基部分的反应机理如图:
下列说法错误的是
| A.H+是该重排反应的催化剂 |
| B.理论上总反应的原子利用率小于100% |
| C.粒子C中N原子的最外层电子数为6 |
D. 的方程式为 的方程式为 |
您最近一年使用:0次
名校
9 . 下列是德国化学家哈伯工业合成氨的流程图,其中关于反应调控的说法不正确的是


| A.操作①是为了减少副反应及对设备的腐蚀 |
| B.操作②和③均既可加快反应速率,又可提高产品产率 |
| C.操作④⑤可提高原料利用率,但不能显著提高反应速率 |
| D.操作③中选择500℃主要是考虑催化剂的活性,同时兼顾反应速率 |
您最近一年使用:0次
名校
10 . 工业制硫酸的重要反应之一是 SO2在 400-500°C 催化氧化:2SO2(g)+ O2(g) 2SO3(g) △H,在一定温度下,将 2mol SO2和 1mol O2充入一定容密闭容器中进行催化氧化, 反应机理如下:
2SO3(g) △H,在一定温度下,将 2mol SO2和 1mol O2充入一定容密闭容器中进行催化氧化, 反应机理如下:
反应Ⅰ:V2 O5 (s)+ SO2 (g) V2 O4 (s) +SO3(g) △H=+24kJ·mol -1
V2 O4 (s) +SO3(g) △H=+24kJ·mol -1
反应Ⅱ:2V2 O4 (s) +O2(g) 2V2 O5 (s) △H=-246kJ·mol -1
2V2 O5 (s) △H=-246kJ·mol -1
反应中的能量变化如右图所示,下列说法不正确的是

 2SO3(g) △H,在一定温度下,将 2mol SO2和 1mol O2充入一定容密闭容器中进行催化氧化, 反应机理如下:
2SO3(g) △H,在一定温度下,将 2mol SO2和 1mol O2充入一定容密闭容器中进行催化氧化, 反应机理如下: 反应Ⅰ:V2 O5 (s)+ SO2 (g)
 V2 O4 (s) +SO3(g) △H=+24kJ·mol -1
V2 O4 (s) +SO3(g) △H=+24kJ·mol -1反应Ⅱ:2V2 O4 (s) +O2(g)
 2V2 O5 (s) △H=-246kJ·mol -1
2V2 O5 (s) △H=-246kJ·mol -1反应中的能量变化如右图所示,下列说法不正确的是

| A.ΔH=-198kJ· mol-1 |
| B.SO2与SO3的物质的量之和恒为 2mol |
| C.使用V2O5是为了提高 SO2的平衡转化率 |
| D.反应速率由反应Ⅱ决定 |
您最近一年使用:0次
2023-08-26更新
|
264次组卷
|
2卷引用:湖北省新高考联盟2023-2024学年高二上学期8月开学联考化学试题



