名校
解题方法
1 . 恒温恒容的密闭容器中,在某催化剂表而上发生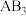 的分解反应:
的分解反应: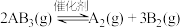 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下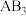 浓度随时间的变化如下表所示。下列说法错误的是
浓度随时间的变化如下表所示。下列说法错误的是
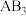 的分解反应:
的分解反应: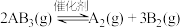 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下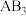 浓度随时间的变化如下表所示。下列说法错误的是
浓度随时间的变化如下表所示。下列说法错误的是| 编号 | 时间/min 表面积/  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
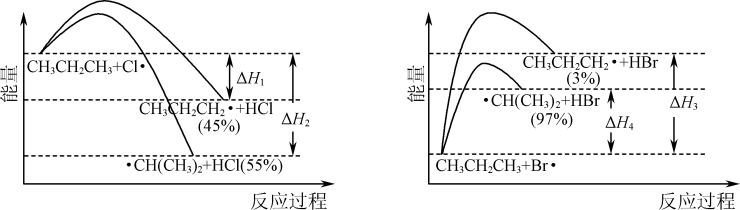
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
A.相同条件下,增加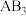 的浓度,反应速率增大 的浓度,反应速率增大 |
B.实验③,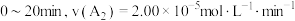 |
C.实验②,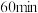 时处于平衡状态, 时处于平衡状态,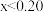 |
| D.相同条件下,增加催化剂的表面积,反应速率增大 |
您最近一年使用:0次
2023-02-12更新
|
233次组卷
|
2卷引用:山东省菏泽第一中学2022-2023学年高二下学期2月教学质量检测化学试题
2 . 一定温度下, 的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述不正确的是
的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述不正确的是
 的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述不正确的是
的氯化、溴化反应势能图及一段时间后产物的选择性如图,下列叙述不正确的是 
A. |
| B.升高温度,体系中n(1-氯丙烷)∶n(2-氯丙烷)的值增大 |
| C.以丙烷为原料合成丙醇时,“先溴代再水解”有利于提高2-丙醇的含量 |
| D.由图可知,丙烷中碳氢键的键能不完全相同 |
您最近一年使用:0次
2022-05-19更新
|
861次组卷
|
2卷引用:浙江省Z20名校联盟(名校新高考研究联盟)2022届高三第三次联考化学试题
2022高三·全国·专题练习
3 . 研究表明,在电解质水溶液中,CO2气体可被电化学还原。在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图。由此判断,CO2电还原为CO从易到难的顺序为_______ (用a、b、c字母排序)。
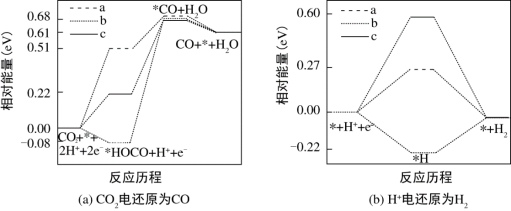

您最近一年使用:0次
4 . 辉铜矿主要成分Cu2S,此外还含有少量SiO2、Fe2O3等杂质,软锰矿主要含有MnO2,以及少量SiO2、Fe2O3等杂质。研究人员开发综合利用这两种资源,用同槽酸浸湿法冶炼工艺,制备硫酸锰晶体和碱式碳酸铜。主要工艺流程如下:
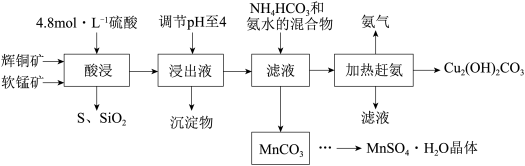
已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
④MnSO4·H2O溶于1份冷水、0.6份沸水,不溶于乙醇。
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要___________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________ (任写一点)。
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:___________ 。
(4)调节浸出液pH=4的作用是___________ 。
(5)写出流程中生成MnCO3的离子方程式___________ 。
(6)MnCO3先加稀硫酸溶解,在经过___________ 得到MnSO4·H2O晶体
(7)本工艺中可循环使用的物质是___________ (写化学式)。

已知:
①MnO2有较强的氧化性,能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水溶液中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀的pH范围(开始沉淀和完全沉淀的pH):
| 金属离子 | Fe3+ | Mn2+ | Cu2+ |
| 开始沉淀pH值 | 1.5 | 8.3 | 4.4 |
| 完全沉淀pH值 | 3.2 | 9.8 | 6.4 |
(1)实验室配制240mL 4.8mol•L-1的稀硫酸,所需的玻璃仪器除玻璃棒、量筒、烧杯以外还需要
(2)酸浸时,为了提高浸取率可采取的措施有
(3)酸浸时,得到浸出液中主要含有CuSO4、MnSO4等。写出该反应的化学方程式:
(4)调节浸出液pH=4的作用是
(5)写出流程中生成MnCO3的离子方程式
(6)MnCO3先加稀硫酸溶解,在经过
(7)本工艺中可循环使用的物质是
您最近一年使用:0次
名校
解题方法
5 . I.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O。
请回答:
(1)实验计时方法是从溶液混合开始计时,至___________ 时计时结束。
(2)V1=___________ ,V2=___________ ;
(3)设计实验Ⅰ.Ⅲ的目的是___________ 。
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有___________ 作用。Ⅳ号实验是为验证你的猜测,实验中要加入的少量某种物质是___________ (填化学式)。
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
上述实验能否说明“相同条件下,反应物浓度越大,反应速率越快”___________ (选填“能”或“不能”);简述你的理由:___________
| 编号 | 酸性KMnO4溶液(0.01mol·L-1) | H2C2O4溶液(0.1mol·L-1) | 水 | 某种物质 | 反应温度(℃) | 反应时间(min) |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 2.1 |
| Ⅱ | V1mL | 2mL | 1mL | 0 | 20 | 5.5 |
| Ⅲ | V2mL | 2mL | 0 | 0 | 50 | 0.5 |
| Ⅳ | 2mL | 2mL | 0 | 少量 | 20 | 0.2 |
(1)实验计时方法是从溶液混合开始计时,至
(2)V1=
(3)设计实验Ⅰ.Ⅲ的目的是
(4)利用实验Ⅲ中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(5)有同学在实验中发现酸性高锰酸钾溶液和草酸溶液反应时,开始一段时间反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。某同学认为是放热导致溶液温度升高所致,重做Ⅰ号实验,测定实验过程中不同时刻溶液的温度,结果温度没有明显变化。由此你得出的结论是:可能是是反应产物有
II.相同温度条件下,分别用3支试管按下列方式完成A、B、C三组实验:
| 试管 | A | B | C |
| 加入试剂 | 4mL0.01mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.02mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 | 4mL0.03mol/LKMnO4 1ml0.1moL/LH2SO4 2mL0.1mol/LH2C2O4 |
| 褪色时间 | 28秒 | 30秒 | 不褪色 |
您最近一年使用:0次
20-21高三下·浙江·阶段练习
6 . 合成氨工业是人工固氮的重要途径,氨气是工农业生产中的重要物质。请回答以下问题:
(1)下列说法不正确的是___________
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHI
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII
不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
①下列说法正确的是___________
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是___________
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g) H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol
第二步:H2NCOONH4(1) CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。
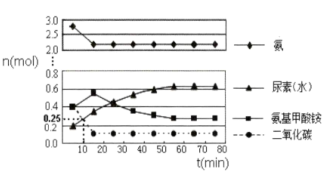
①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为___________
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是___________ 。
(1)下列说法不正确的是
A.实验室制备氨气时,可以用CaCl2固体干燥氨气
B.在浓氨水中加入生石灰可制备少量氨气
C.合成氨塔中,需要有热交换装置,便于能量的有效利用
D.合成氨工业中,可将氨气液化,并不断将液氨移去,利于提高NH3的产率
(2)氨是制取硝酸的重要原料。氨的催化氧化过程主要有以下两个反应:
I.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ΔHI
4NO(g)+6H2O(g) ΔHIII.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ΔHII
2N2(g)+6H2O(g) ΔHII不同温度下氨氧化的平衡常数如下(p=0.1013Mpa):
| 温度(℃) | 300 | 500 | 700 | 900 | 1100 |
| 反应I(KI) | 6.3×1041 | 1.1×1026 | 2.1×1019 | 3.8×1015 | 3.4×1011 |
| 反应II(KII) | 7.3×1056 | 7.1×1034 | 2.6×1025 | 1.5×1020 | 6.7×1016 |
A.ΔHI>0,ΔHII>0
B.如果对反应不加控制,氨和氧气反应的最终产物主要是N2
C.为使反应有利于朝生成更多的NO方向进行,不必关注热力学问题(平衡移动问题),需要关注动力学问题(反应速率问题)
D.在实际生产中,需采用高压氧化,以利于提高NO的产率
E.反应中需控制氨氧比、选择性催化剂的形状、气固相接触时间等
②在实际工业生产中,温度一般需要在750℃~850℃左右,其主要原因是
(3)已知可通过下列方法合成尿素:
第一步:2NH3(1)+CO2(g)
 H2NCOONH4(1) ΔH=-159.5kJ/mol
H2NCOONH4(1) ΔH=-159.5kJ/mol第二步:H2NCOONH4(1)
 CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol
CO(NH2)2(1)+H2O(1) ΔH=+28.5kJ/mol在体积为5L的密闭容器中加入1molCO2和4molNH3,在一定条件下反应进行到10min时,测得CO2和尿素的物质的量均为0.25mol,如图所示。

①若用单位时间内物质的量的变化来表示固体或纯液体的反应速率,则10min内第一步反应中生成H2NCOONH4(1)[氨基甲酸铵]的平均反应速率为
②反应进行15分钟后,随着时间的变化,尿素和氨基甲酸铵的物质的量变化比较明显,但氨气和二氧化碳的变化很小,其主要原因是
您最近一年使用:0次



