名校
1 . 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。CO2可转化成有机物实现碳循环。在体积为2L的恒温密闭容器中,充入1molCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)前10min, (CO2)=
(CO2)=____ mol·L-1·min-1。
(2)能说明上述反应达到平衡状态的是____ (填字母)。
a.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
b.混合气体的压强不随时间的变化而变化
c.单位时间内生成1molH2O,同时生成1molCH3OH
d.混合气体的平均相对分子质量不随时间的变化而变化
e.混合气体的密度不随时间的变化而变化
f.CO2和CH3OH的反应速率之比为1∶1
(3)反应前与平衡时的压强比为____ 。
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是____ 。
(5)平衡时H2的转化率为____ 。

(1)前10min,
 (CO2)=
(CO2)=(2)能说明上述反应达到平衡状态的是
a.反应中CO2与CH3OH的物质的量浓度之比为1:1(即图中交叉点)
b.混合气体的压强不随时间的变化而变化
c.单位时间内生成1molH2O,同时生成1molCH3OH
d.混合气体的平均相对分子质量不随时间的变化而变化
e.混合气体的密度不随时间的变化而变化
f.CO2和CH3OH的反应速率之比为1∶1
(3)反应前与平衡时的压强比为
(4)平衡混合气体中CO2(g)和H2(g)的质量之比是
(5)平衡时H2的转化率为
您最近一年使用:0次
2022-04-29更新
|
172次组卷
|
3卷引用:山西省长治市第二中学校2021-2022学年高一下学期期中考试化学试题
名校
解题方法
2 . 向一个密闭容器中充入1mol 和3mol H2,在一定条件下使其发生反应生成
和3mol H2,在一定条件下使其发生反应生成 。达到平衡时,下列说法中正确的是
。达到平衡时,下列说法中正确的是
 和3mol H2,在一定条件下使其发生反应生成
和3mol H2,在一定条件下使其发生反应生成 。达到平衡时,下列说法中正确的是
。达到平衡时,下列说法中正确的是A. 、H2和 、H2和 的物质的量浓度之比为1:3:2 的物质的量浓度之比为1:3:2 |
B. 完全转化为 完全转化为 |
| C.正反应速率和逆反应速率都为零 |
D.单位时间内消耗amol ,同时消耗2amol ,同时消耗2amol |
您最近一年使用:0次
2021-12-02更新
|
1799次组卷
|
10卷引用:山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题
山西省大同市第一中学校2023-2024学年高二上学期10月月考化学试题人教2019版选择性必修一第二章 化学反应速率与化学平衡 复习与提高湖北省鄂州市2021-2022学年高二上学期期末质量监测化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期开学考试化学试题 黑龙江省牡丹江市海林市朝鲜族中学2022-2023学年高二上学期第一次月考化学试题黑龙江省虎林市高级中学2022-2023学年高二上学期期中考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修1第2单元02基础练四川省甘孜藏族自治州泸定中学2023-2024学年高二上学期11月期中考试化学试题甘肃省白银市会宁县第四中学2023-2024学年高二上学期第一次月考化学试题广西钦州市第四中学2023-2024学年高二上学期10月考试化学试卷
3 . 在一密闭容器中进行反应: .已知反应过程中某一时刻X、Y、Z的浓度分别为
.已知反应过程中某一时刻X、Y、Z的浓度分别为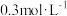 、
、 、
、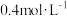 ,当反应达到平衡时,可能存在的是
,当反应达到平衡时,可能存在的是
 .已知反应过程中某一时刻X、Y、Z的浓度分别为
.已知反应过程中某一时刻X、Y、Z的浓度分别为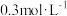 、
、 、
、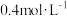 ,当反应达到平衡时,可能存在的是
,当反应达到平衡时,可能存在的是A. | B.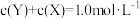 |
C.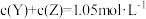 | D.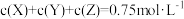 |
您最近一年使用:0次
2021-06-09更新
|
150次组卷
|
2卷引用:山西省2020-2021学年高二下学期5月考试化学试题
名校
4 . 一定温度和压强下,在2L的密闭容器中合成氨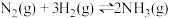 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法不正确的是
。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法不正确的是
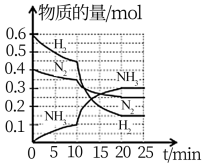
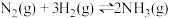 。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法不正确的是
。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。下列说法不正确的是
A.0~10min内,以 表示的平均反应速率为 表示的平均反应速率为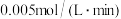 |
B.10~20min内, 浓度变化的原因可能是缩小容器容积 浓度变化的原因可能是缩小容器容积 |
C. 的平衡转化率与 的平衡转化率与 平衡转化率相等 平衡转化率相等 |
| D.该反应在20min时达到化学平衡状态 |
您最近一年使用:0次
2021-05-21更新
|
204次组卷
|
2卷引用:山西省怀仁市2020-2021学年高一下学期期中化学试题
5 . 我国科学家使用双功能催化剂(能吸附不同粒子)催化水煤气变换反应: ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
,在低温下获得高转化率与高反应速率。反应过程示意图如下:
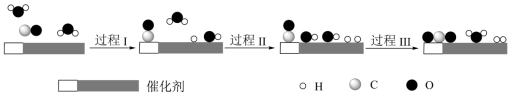
下列说法正确的是
 ,在低温下获得高转化率与高反应速率。反应过程示意图如下:
,在低温下获得高转化率与高反应速率。反应过程示意图如下:
下列说法正确的是
| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.该催化过程中:有极性键和非极性键的断裂,也有极性键和非极性键的形成 |
C.图示显示:起始时的2个 在反应过程中并未都参与了反应 在反应过程中并未都参与了反应 |
D.一定条件下,当CO和 反应未达到限度时, 反应未达到限度时, |
您最近一年使用:0次
2021-05-21更新
|
168次组卷
|
2卷引用:山西省怀仁市2020-2021学年高一下学期期中化学试题
名校
解题方法
6 . 恒温时,向2L密闭容器中通入一定量的气体X和Y,发生反应:2X(g)+Y(g)⇌3Z(g)。Y的物质的量随时间变化的曲线如图所示。下列说法正确的是
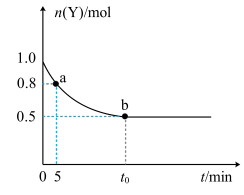

| A.a点时,正反应速率小于逆反应速率 |
| B.0~5min内,以X表示的反应速率是0.02mol·L-1·min-1 |
| C.b点时该反应达到了最大限度,反应停止 |
| D.t0min时,c(Z)=0.75mol·L-1 |
您最近一年使用:0次
2021-05-11更新
|
243次组卷
|
3卷引用:山西省大同市灵丘一中、广灵一中2020-2021学年高一下学期期中联考化学试题
10-11高一下·山西临汾·期中
名校
解题方法
7 . 下列有关反应2SO2+O2 2SO3的说法中不正确的是
2SO3的说法中不正确的是
 2SO3的说法中不正确的是
2SO3的说法中不正确的是| A.该反应为可逆反应,故在一定条件下二氧化硫与氧气不可能全部转化为三氧化硫 |
| B.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
您最近一年使用:0次
2021-04-28更新
|
159次组卷
|
11卷引用:2010-2011学年山西省临汾一中高一下学期期中考试化学试卷
(已下线)2010-2011学年山西省临汾一中高一下学期期中考试化学试卷(已下线)2011-2012学年云南省开远四中高一下学期期中考试化学试卷(已下线)2011-2012学年河北省邢台一中高一下学期期末考试化学试卷2015-2016学年贵州遵义航天中学高二上第三次月考化学卷《课时同步君》2017-2018学年高一化学人教必修2-2.3.2 化学反应的限度(已下线)2018年12月27日 《每日一题》人教选修4-可逆反应黑龙江省哈尔滨市第六中学校2019-2020学年高一下学期返校适应训练化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题天津市两校联考2021-2022学年高二上学期第二次质量检测化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题(已下线)6.2.2 化学平衡(第2课时 化学平衡移动)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)
8 . 在一个容积3L的密闭容器里进行如下反应N2(g) +3H2(g)⇌2NH3(g),反应开始时n(N2)=1.5mol,n(H2)=4.4mol,2min末n(H2)=0.8mol。
(1)前2min内用NH3表示的该反应的反应速率_______ ;
(2)2min末N2的浓度_______ ;
(3)2min末N2的转化率_______ ;
(4)一段时间后,下列各关系中能说明该反应已达到平衡状态的是:_______ 。
A.3υ正(N2)=υ正(H2) B.N2、H2、NH3的浓度不再变化
C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2)
(1)前2min内用NH3表示的该反应的反应速率
(2)2min末N2的浓度
(3)2min末N2的转化率
(4)一段时间后,下列各关系中能说明该反应已达到平衡状态的是:
A.3υ正(N2)=υ正(H2) B.N2、H2、NH3的浓度不再变化
C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2)
您最近一年使用:0次
名校
解题方法
9 . 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是
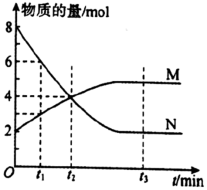

A.化学方程式:2N M M |
| B.t2时,正、逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,M的浓度是N的浓度的2倍 |
您最近一年使用:0次
2021-02-19更新
|
976次组卷
|
5卷引用:山西省长治市第一中学校2021-2022学年高一下学期第六次练考化学试题
13-14高二下·浙江温州·期中
10 . 在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2,发生如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
 2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )
2SO3(g) ΔH<0。2 min后,反应达到平衡,生成SO3为1.4 mol,同时放出热量Q kJ,则下列分析正确的是( )| A.在该条件下,反应前后的压强之比为6∶5.3 |
| B.若反应开始时容器容积为2 L,则0—2min内v(SO3)=0.35 mol·L-1·min-1 |
| C.若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4 mol |
| D.若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
您最近一年使用:0次
2020-08-10更新
|
724次组卷
|
25卷引用:【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题
【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题(已下线)2013-2014浙江省温州中学高二下学期期中化学试卷(已下线)2014届浙江省温州中学高二下学期期中化学试卷 (已下线)2015届安徽省六校教育研究会高三第一次联考化学试卷2015-2016学年辽宁省沈阳二中高二上10月月考化学试卷2015-2016学年天津市静海一中等六校高二上学期期末联考化学试卷2016-2017学年江西省上高二中高二上9月月考化学试卷广西陆川县中学2017-2018学年高二上学期期末考试化学试题河南省固始县2017-2018学年上期期末高中二年级期末化学试题【校级联考】天津市七校(静海一中、宝坻一中、杨村一中等)2018-2019学年高二上学期期末考试化学试题江西省上高县第二中学2019-2020学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期阶段性检测(一)化学试题(已下线)第2章 章末检测-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)2.3.1化学平衡状态(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)辽宁省沈阳市法库县高级中学2020-2021学年高二9月月考化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题(已下线)第23讲 化学平衡状态 化学平衡的移动(精练)-2021年高考化学一轮复习讲练测江西省上高二中2020-2021学年高二上学期第三次月考化学试题黑龙江省哈尔滨市宾县第一中学2021届高三上学期第三次月考化学试题江西省赣州市信丰中学2020-2021学年高二上学期入学考试化学试题新疆乌鲁木齐市第八中学2018-2019学年高二上学期期中考试化学试题(已下线)第19讲 化学平衡 (练) — 2022年高考化学一轮复习讲练测(新教材新高考)安徽省宿州市十三所重点中学2021-2022学年高二上学期期末质量检测(理科人教版)化学试题山东省青岛第二中学2020-2021学年高二上学期期中考试化学试题内蒙古赤峰第四中学2023-2024学年高二上学期12月期中考试化学试题



