名校
1 . 现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_______ 热反应,且m+n ______ p (填“>”、“<”或“=”)。
(2)减压时,A 的质量分数_______ (填“增大”、“减小”或“不变”,下同)。
(3)若加入 B(体积不变),则A的转化率__________ 。
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将_______ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_______ 。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)该反应的逆反应为
(2)减压时,A 的质量分数
(3)若加入 B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比[B]/[C]将
(5)若加入催化剂,平衡时气体混合物的总物质的量
您最近一年使用:0次
2023-02-07更新
|
244次组卷
|
7卷引用:贵州省贵阳市清镇养正学校2019-2020学年高二上学期期中考试化学试题
解题方法
2 . I.甲醇水蒸气重整制氢(SRM)系统简单,产物中H2含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。其反应如下:
反应1(主):
反应2(副):
温度高于300C则会同时发生反应3: ,回答下列问题:
,回答下列问题:
(1)反应1能够自发进行的原因是_______ 。
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是_______ 。
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应_______ 。
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
①反应I的平衡常数表达式K1=_______ ;
②b_______ 0(填“>”“<”或“=”),c与a、b之间的定量关系为_______ 。
③K3=_______ ,若反应Ⅲ是在500℃、容积为2L的密闭容器中进行的,测得某一时刻体系内 的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率
的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率_______ (填“>”“<”或“=”)CH3OH的消耗速率。
④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是_______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。
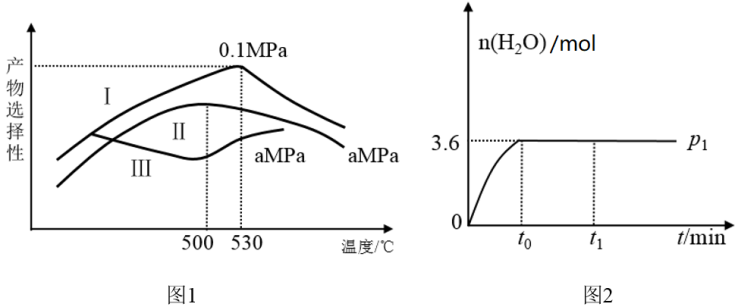
①为尽可能的获得乙烯,控制的生产条件为_______
②一定温度下某密闭容器中存在反应: 。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为_______ (保留三位有效数字)。
反应1(主):

反应2(副):

温度高于300C则会同时发生反应3:
 ,回答下列问题:
,回答下列问题:(1)反应1能够自发进行的原因是
(2)升温有利于提高CH3OH转化率,但也存在一个明显的缺点是
II.甲制取低碳烯烃技术(DMTO)项目曾摘取了2014年度国家技术发明奖一等奖。DMTO主要包括煤的气化、液化、烯烃化三个阶段。回答下列问题:
(1)煤的气化。用化学方程式表示煤的气化的主要反应
(2)煤的液化。下表中某些反应是煤的液化过程中的反应:
| 热化学方程式 | 平衡常数 | |
| 500℃ | 700℃ | |
I. | 2.0 | 0.2 |
II. | 1.0 | 2.3 |
III. | K3 | 4.6 |
①反应I的平衡常数表达式K1=
②b
③K3=
 的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率
的物质的量分别为6mol、2mol、10mol、10mol,则此时CH3OH的生成速率④对于反应III,在一容积不变的密闭容器中,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用合适的催化剂 D.充入He,使体系总压强增大
(3)烯烃化阶段。图1是某工厂烯烃化阶段产物中乙烯、丙烯的选择性与温度、压强之间的关系(选择性:指生成某物质的百分比。图中I、II表示乙烯,III表示丙烯)。

①为尽可能的获得乙烯,控制的生产条件为
②一定温度下某密闭容器中存在反应:
 。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
。在压强为P1时产物水的物质的量与时间的关系如图2所示,若t0时刻测得甲醇的体积分数为10%,此时甲醇乙烯化的转化率为
您最近一年使用:0次
13-14高二上·贵州·期中
名校
3 . 在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则| A.平衡向正反应方向移动了 | B.平衡向逆反应方向移动了 |
| C.物质B的质量分数减小了 | D.a>b |
您最近一年使用:0次
2018-12-12更新
|
164次组卷
|
3卷引用:2013-2014学年贵州省重点高中高二上学期期中考试理科化学试卷
(已下线)2013-2014学年贵州省重点高中高二上学期期中考试理科化学试卷陕西省汉中中学2018-2019学年高二上学期期中考试化学试题广东省湛江市第二十一中学2019-2020学年高二下学期开学考试化学试题
解题方法
4 . Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因_________________ (用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________ 。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+ O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol
H2(g)+ O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
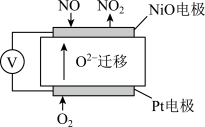
①Pt电极上发生的是______________ 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________ ;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
0~5min内,该反应的平均反应速率V(NO)=___________________ ;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+
 O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol H2(g)+
 O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/molCH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:

①Pt电极上发生的是
②NiO电极上的电极反应式为
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
| 时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
| 比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是
您最近一年使用:0次
5 . 在容器可变的密闭容器中,反应N2(g)+3H2(g) 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:
(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正______ (选填“增大”、“减小”,下同),v逆______ ,平衡向______ 方向移动(选填“正反应”、“逆反应”)。
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为______ 反应(选填“吸热”、“放热”)。
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是______ (填写编号)。
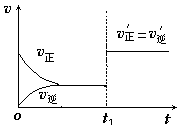
a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量______ (选填“增大”、“减小”、“不变”)。
 2NH3(g)在一定条件下达到平衡。完成下列填空:
2NH3(g)在一定条件下达到平衡。完成下列填空:(1)在其他条件不变的情况下,缩小容器体积以增大反应体系的压强,v正
(2)在其他条件不变的情况下,降低温度平衡向正反应方向移动,为
(3)如图为反应速率(ν)与时间(t)关系的示意图,由图判断,在t1时刻曲线发生变化的原因是

a.增大N2的浓度 b.扩大容器体积 c.加入催化剂 d.升高温度
改变条件后,平衡混合物中NH3的百分含量
您最近一年使用:0次



