解题方法
1 . 硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如图:
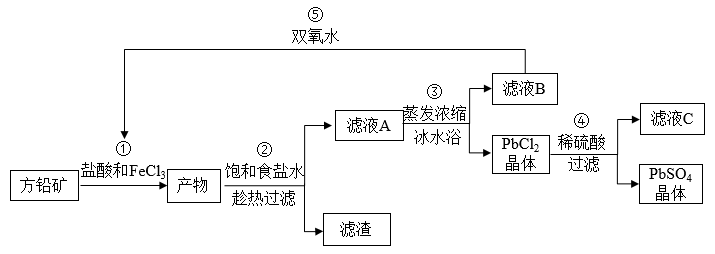
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) PbCl
PbCl (aq)△H>0
(aq)△H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7。
(1)过程①中可以加快反应速率和提高原料利用率的方法是___ 、___ (写出2种即可)。
(2)①中生成淡黄色沉淀的离子方程式是___ ,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____ 。
(3)用化学平衡移动的原理解释③中使用冰水浴的原因是___ 。
(4)上述流程中可循环利用的物质有___ 。
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造
成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH) 、Pb(OH)
、Pb(OH) 。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为____ 。
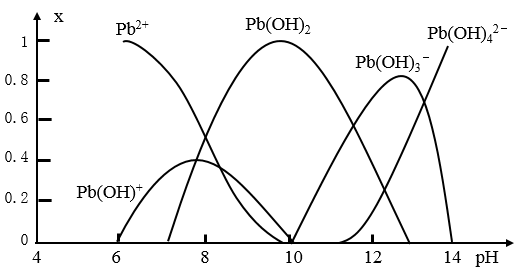
(6)用铅蓄电池电解浓度较大的CuCl2溶液,两极均用石墨做电极,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=___ mol·L-1(已知:Cu(OH)2的Ksp=2.2×10-20)。

已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq)
 PbCl
PbCl (aq)△H>0
(aq)△H>0③Fe3+、Pb2+以氢氧化物形式开始沉淀时的pH值分别为1.9和7。
(1)过程①中可以加快反应速率和提高原料利用率的方法是
(2)①中生成淡黄色沉淀的离子方程式是
(3)用化学平衡移动的原理解释③中使用冰水浴的原因是
(4)上述流程中可循环利用的物质有
(5)炼铅和用铅都会使水体因重金属铅的含量增大而造
成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)
 、Pb(OH)
、Pb(OH) 。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
。各形态的铅浓度分数x与溶液pH变化的关系如图所示:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为
(6)用铅蓄电池电解浓度较大的CuCl2溶液,两极均用石墨做电极,当电解到一定程度,阴极附近出现蓝色Cu(OH)2絮状物。常温下,经测定阴极附近溶液的pH=m,此时阴极附近c(Cu2+)=
您最近一年使用:0次
2020-12-08更新
|
134次组卷
|
2卷引用:河北省秦皇岛市青龙满族自治县实验中学等2校2023届高三下学期开学考试化学试题
名校
2 . 碳和氮的化合物在生产、生活中广泛存在。请回答下列问题:
(1)甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
①下列措施能使反应③的平衡体系中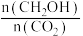 增大的是
增大的是_______ (填字母代号)。
A.将H2O(g)从体系中分离出去
B.恒容充入H2(g), 使体系压强增大
C.升高温度
D.恒容时再充入l mol H2(g)
②500℃时测得反应③在某时刻H2(g)、CO2(g)、 CH3OH(g)、 H2O(g)的浓度分别为0.8 mol/L、0.1 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)________ (填“>”“ =“或“<")v (逆)。
(2)如图表示反应N2(g)+3H2(g) 2NH3(g) △H<0 在某一时间段反应速率与反应过程的曲线关系图:
2NH3(g) △H<0 在某一时间段反应速率与反应过程的曲线关系图:
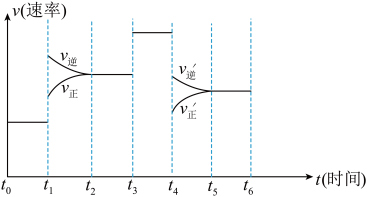
①达到平衡后,若只改变一个条件,则t1条件为_____ ;t3条件为_____ ;t4条件为_____ ;
②则图中氨的百分含量最低的时间段是________ (填选项字母).
A. t0-t1 B. t2-t3 C. t3-t4 D. t5-t6 .
③请在上图中画出t6时刻既增加氢气浓度同时又减小氨气浓度的速率随时间的变化图____________ 。
(1)甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 化学平衡常数 | 温度(℃) | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g CH3OH(g) △H CH3OH(g) △H | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) H2O(g)+CO(g) △H2 H2O(g)+CO(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) H3OH(g)+ H2O(g) △H3 H3OH(g)+ H2O(g) △H3 | K3 | |||
①下列措施能使反应③的平衡体系中
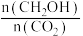 增大的是
增大的是A.将H2O(g)从体系中分离出去
B.恒容充入H2(g), 使体系压强增大
C.升高温度
D.恒容时再充入l mol H2(g)
②500℃时测得反应③在某时刻H2(g)、CO2(g)、 CH3OH(g)、 H2O(g)的浓度分别为0.8 mol/L、0.1 mol/L、0.3 mol/L、0.15 mol/L,则此时v(正)
(2)如图表示反应N2(g)+3H2(g)
 2NH3(g) △H<0 在某一时间段反应速率与反应过程的曲线关系图:
2NH3(g) △H<0 在某一时间段反应速率与反应过程的曲线关系图:
①达到平衡后,若只改变一个条件,则t1条件为
②则图中氨的百分含量最低的时间段是
A. t0-t1 B. t2-t3 C. t3-t4 D. t5-t6 .
③请在上图中画出t6时刻既增加氢气浓度同时又减小氨气浓度的速率随时间的变化图
您最近一年使用:0次
名校
解题方法
3 . 如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g) CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________________ 。下图是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____________ 反应(填“放热”或“吸热”)。

(2)500℃该反应的平衡常数为______ (保留两位小数),若提高温度到800℃进行,达平衡时,K值______ (填“增大”、“减小”或“不变”)。
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)______ v(逆)(填“>”、“<”或“=”)。
(4)下列措施能使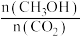 增大的是
增大的是______ 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
 CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图所示:
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=

(2)500℃该反应的平衡常数为
(3)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正)
(4)下列措施能使
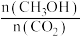 增大的是
增大的是A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
您最近一年使用:0次
2019-09-26更新
|
308次组卷
|
3卷引用:河北省鹿泉第一中学2019-2020学年高二9月月考化学试题
名校
4 . 对于平衡体系2SO2(g)+O2(g) 2SO3(g),增大压强时(其它条件不变)
2SO3(g),增大压强时(其它条件不变)
 2SO3(g),增大压强时(其它条件不变)
2SO3(g),增大压强时(其它条件不变)| A.SO3含量降低 | B.正反应速率加快 |
| C.逆反应速率减慢 | D.平衡向逆向移动 |
您最近一年使用:0次
2019-06-23更新
|
350次组卷
|
5卷引用:河北省衡水市深州市中学2019-2020学年高二下学期期中考试化学试题
河北省衡水市深州市中学2019-2020学年高二下学期期中考试化学试题2019年上海市浦东新区高中学业水平合格考试(模拟)化学试题(已下线)2019年9月12日 《每日一题》选修4—— 影响化学平衡移动的因素(1)吉林省白山市抚松县第五中学2020-2021学年高二上学期期中考试化学试题上海市奉贤区致远高级中学2021-2022学年高二上学期期中教学评估(合格考)化学试题
2017高二·全国·课时练习
名校
5 . 下列变化一定会引起平衡移动的是
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化 ⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化
| A.①②⑥⑦⑧ | B.②④⑤⑥⑧ |
| C.②④⑤⑥⑦ | D.③④⑦⑧ |
您最近一年使用:0次
2017-11-23更新
|
1101次组卷
|
11卷引用:河北省石家庄市第二中学2019-2020高一下学期期末考试模拟化学试题(一)
河北省石家庄市第二中学2019-2020高一下学期期末考试模拟化学试题(一)(已下线)2.3.2 影响化学平衡状态的因素安徽省江淮名校2017-2018学年高二期中考试化学试题高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第三节 化学平衡 化学平衡第二课时(化学平衡状态)(已下线)2018年9月16日 《每日一题》人教选修4-每周一测(已下线)2019年9月15日 《每日一题》选修4—— 每周一测山西省应县第一中学校2019-2020学年高二上学期第一次月考化学试题江西省上饶市横峰中学、铅山一中、弋阳一中2020-2021学年高二上学期开学联考化学试题(课改班)甘肃省武威第一中学2020-2021学年高二上学期期中考试化学试题辽宁省丹东市凤城市第一中学2021-2022学年高二上学期10月份月考化学试题陕西省西安市西航一中2021-2022学年高二下学期第一次月考试题
名校
6 . 已知反应A2(g)+2B2(g) 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是
 2AB2(g) ΔH<0,下列说法正确的是
2AB2(g) ΔH<0,下列说法正确的是| A.达平衡后降低温度,混合气体平均相对分子质量减小 |
| B.使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率 |
| C.达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变 |
| D.达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
您最近一年使用:0次
2017-04-22更新
|
202次组卷
|
4卷引用:河北省安平中学2019-2020学年高二上学期第一次月考化学试题



