名校
解题方法
1 . 探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.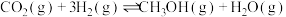
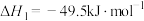
Ⅱ.

Ⅲ.

回答下列问题:
(1)
___________ kJ⋅mol-1。
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为___________ mol/L(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为___________ 。
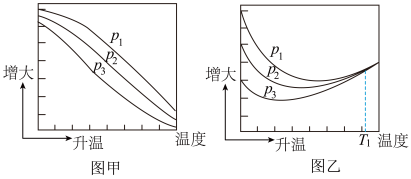
(3)不同压强下,按照 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知: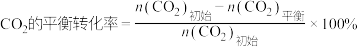
CH3OH的平衡产率=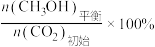
其中纵坐标表示CO2平衡转化率的是图___________ (填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为___________ ;图乙中T1温度时,三条曲线几乎交于一点的原因是___________ 。
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
(5)甲醇燃料电池中甲醇在___________ (填“正”或“负”)极发生反应,酸性条件下其正极的电极反应式为___________ 。
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为___________ 。
Ⅰ.
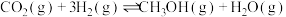
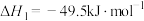
Ⅱ.


Ⅲ.


回答下列问题:
(1)

(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中
 为a mol,CO为b mol,此时
为a mol,CO为b mol,此时 的浓度为
的浓度为(3)不同压强下,按照
 投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如下图所示。
已知:
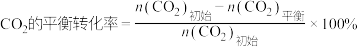
CH3OH的平衡产率=
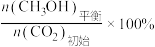
其中纵坐标表示CO2平衡转化率的是图
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为___________(填标号)。
| A.低温、高压 | B.高温、低压 | C.低温、低压 | D.高温、高压 |
(5)甲醇燃料电池中甲醇在
(6)在允许O2-自由迁移的固体电解质燃料电池中,CnH2n+2放电的电极反应式为
您最近一年使用:0次
2024-03-16更新
|
237次组卷
|
2卷引用:河南省漯河市高级中学2023-2024学年高三下学期3月月考化学试题
名校
解题方法
2 . 1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。图1是哈伯法的流程图,图2是反应历程。

(1)写出合成 的热化学方程式
的热化学方程式_______ 。已知该反应的 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
_______ kJ⋅mol 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因_______ 。
(2)步骤③采用的催化剂是_______ ,使用催化剂后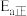
_______ (填“增大”、“减小”或“不变”,下同),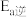
_______ 。
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
(4)500℃、20MPa时,将 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:

①反应开始到第10 min, 的平均反应速率为
的平均反应速率为_______ mol-1⋅L-1⋅min-1。
②反应进行到10 min至20 min时改变的条件可能是_______ 。
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了
③在25min改变条件后,平衡_______ (填“正”或“逆”)向移动,达到新平衡后 的体积分数比原平衡
的体积分数比原平衡_______ (填“大”或“小”)。

(1)写出合成
 的热化学方程式
的热化学方程式 J⋅mol
J⋅mol ⋅K
⋅K ,计算常温下:
,计算常温下:
 。但实际上该反应常温下很难发生,请从分子结构角度解释原因
。但实际上该反应常温下很难发生,请从分子结构角度解释原因(2)步骤③采用的催化剂是
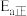
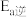
(3)图1中为提高原料转化率而采取的措施是_______(选填编号)。
| A.①②③ | B.②④⑤ | C.①③⑤ | D.②③④ |
 和
和 置于一容积为2L的密闭容器中发生反应。反应过程中
置于一容积为2L的密闭容器中发生反应。反应过程中 、
、 和
和 物质的量变化如图所示,回答下列问题:
物质的量变化如图所示,回答下列问题:
①反应开始到第10 min,
 的平均反应速率为
的平均反应速率为②反应进行到10 min至20 min时改变的条件可能是
a.缩小容器体积 b.升温 c.使用了催化剂 d.加入了

③在25min改变条件后,平衡
 的体积分数比原平衡
的体积分数比原平衡
您最近一年使用:0次
2023-04-03更新
|
270次组卷
|
2卷引用:上海市交通大学附属中学2022-2023学年高二下学期摸底考化学试题
名校
解题方法
3 . CO2的资源化利用一直是科学研究的热点领域。回答下列问题
(1)CO2的甲烷化反应为:CO2(g)+4H2(g) CH4(g)+2H2O(g) △H,该反应又称Sabatier反应。相关的化学键键能数据如表,上述反应的△H=
CH4(g)+2H2O(g) △H,该反应又称Sabatier反应。相关的化学键键能数据如表,上述反应的△H=______ kJ•mol-1。
(2)以CO2和H2为原料合成甲醇(CH3OH)。300℃时,将6molCO2和8molH2的气态混合物充入2L密闭容器中发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<0,该容器中n(H2)随时间变化如图中实线所示:
CH3OH(g)+H2O(g) △H<0,该容器中n(H2)随时间变化如图中实线所示:
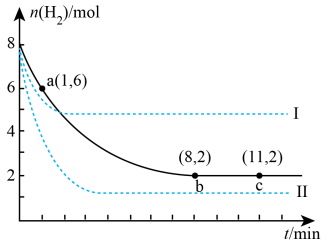
①从反应开始到a点,用CO2表示的反应速率为v(CO2)=______ (保留2位有效数字),此时H2的转化率为______ 。
②根据图中平衡状态计算该反应的平衡常数______ 。
③图中虚线______ (填“I”或“Ⅱ”)表示的是该反应升温时n(H2)随时间变化的曲线,判断依据______ 。
(3)以CO2、NaCl和NH3为原料可以制备NaHCO3。如图为某实验测得NaHCO3溶液的pH随温度的变化曲线(不考虑水挥发)。
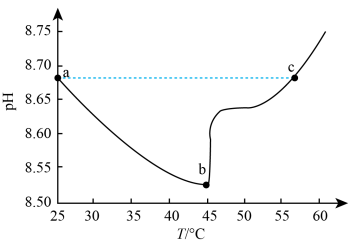
溶液中的c(OH-):a点______ c点(填“>”“<”或“=”)。
(1)CO2的甲烷化反应为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g) △H,该反应又称Sabatier反应。相关的化学键键能数据如表,上述反应的△H=
CH4(g)+2H2O(g) △H,该反应又称Sabatier反应。相关的化学键键能数据如表,上述反应的△H=| 化学键 | H-H | H-O | C-H | C=O |
| E(kJ•mol-1) | 436 | 463 | 413 | 803 |
 CH3OH(g)+H2O(g) △H<0,该容器中n(H2)随时间变化如图中实线所示:
CH3OH(g)+H2O(g) △H<0,该容器中n(H2)随时间变化如图中实线所示:
①从反应开始到a点,用CO2表示的反应速率为v(CO2)=
②根据图中平衡状态计算该反应的平衡常数
③图中虚线
(3)以CO2、NaCl和NH3为原料可以制备NaHCO3。如图为某实验测得NaHCO3溶液的pH随温度的变化曲线(不考虑水挥发)。

溶液中的c(OH-):a点
您最近一年使用:0次
名校
解题方法
4 . 乙烯是制造塑料、合成橡胶和合成纤维等化学产品的基本原料,乙烷直接裂解、乙烷二氧化碳氧化裂解和乙烷氧气氧化裂解和乙烷氧气氧化裂解制备乙烯的反应如下:
(Ⅰ)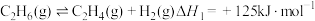
(II)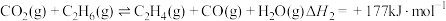
(III)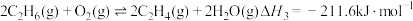
回答下列问题:
(1)已知键能: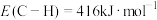 ,
,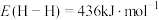 ,由此计算生成
,由此计算生成 碳碳
碳碳 键放出的能量为
键放出的能量为___________ kJ。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的是___________(填序号)。
(3)K为平衡常数,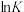 与温度的倒数
与温度的倒数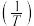 的变化如图所示,a,b两条直线中表示反应(II)的直线是
的变化如图所示,a,b两条直线中表示反应(II)的直线是___________ (填字母),理由是___________ 。

(4) 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为
时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为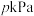 ,此时乙烷的平衡转化率为
,此时乙烷的平衡转化率为 ,反应的平衡常数
,反应的平衡常数 =
=___________  (用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(5)已知Arrhenius经验公式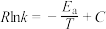 (
( 为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能
为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能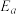 =
=___________  。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是___________ 。

(6)电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现 和
和 两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为
两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为___________ 。若生成的乙烯和乙烷的体积比为3:1,则消耗的 和
和 ,物质的量之比为
,物质的量之比为___________ 。
(Ⅰ)
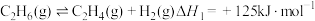
(II)
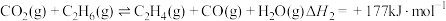
(III)
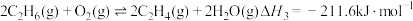
回答下列问题:
(1)已知键能:
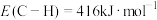 ,
,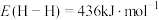 ,由此计算生成
,由此计算生成 碳碳
碳碳 键放出的能量为
键放出的能量为(2)上述反应体系在一定条件下建立平衡后,下列说法正确的是___________(填序号)。
| A.反应(I)加入催化剂,可降低反应的焓变 |
| B.恒压掺入Ar能提高反应(II)的平衡产率 |
| C.降低温度,反应(II)的正反应速率降低、逆反应速率增大 |
| D.增加乙烷的浓度,反应(I)和(II)的平衡均向右移动 |
(3)K为平衡常数,
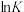 与温度的倒数
与温度的倒数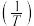 的变化如图所示,a,b两条直线中表示反应(II)的直线是
的变化如图所示,a,b两条直线中表示反应(II)的直线是
(4)
 时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为
时,将乙烷与氦气的混合气体(乙烷的物质的量分数为m%)通入一密闭容器中发生反应(I)。平衡时容器压强为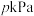 ,此时乙烷的平衡转化率为
,此时乙烷的平衡转化率为 ,反应的平衡常数
,反应的平衡常数 =
= (用题中所给字母表示,并化简,分压=总压×物质的量分数)。
(用题中所给字母表示,并化简,分压=总压×物质的量分数)。(5)已知Arrhenius经验公式
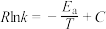 (
( 为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能
为活化能,k为速率常数,R和C为常数),反应(II)的Arrhenius经验公式实验数据如图甲中直线a所示,该反应的活化能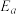 =
= 。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
。当改变外界条件时,实验数据如图中直线b所示,则实验可能改变的外界条件是
(6)电有机合成是制备有机物的一种常用方法,相关研究团队利用电化学装置实现
 和
和 两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为
两种分子的耦合转化来制备乙烯等物质,其原理如图乙所示。阴极上的电极反应式为 和
和 ,物质的量之比为
,物质的量之比为
您最近一年使用:0次
2022-12-16更新
|
273次组卷
|
2卷引用:重庆市第八中学校2023届高三上学期高考适应性月考卷(四)化学试题
解题方法
5 . 甲醇是一种用途十分广泛的有机化工原料。
(1) 作为未来的重要碳源,其选择性加氢合成
作为未来的重要碳源,其选择性加氢合成 一直是研究热点。在
一直是研究热点。在 加氢合成
加氢合成 的体系中,同时发生以下反应:
的体系中,同时发生以下反应:
反应ⅰ: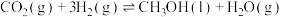

反应ⅱ:

反应ⅲ: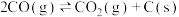

若某容器中同时发生上述反应ⅰ、ⅱ、ⅲ,一定条件下建立平衡后,下列说法正确的是___________(填序号)。
(2)设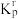 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以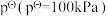 。反应ⅰ、ⅱ、ⅲ的
。反应ⅰ、ⅱ、ⅲ的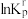 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。

①反应ⅰ、ⅱ、ⅲ中,正反应活化能小于逆反应活化能的反应有___________ 。
②反应ⅰ的相对压力平衡常数表达式为
___________ [用p(x)表示x的分压]。
③在A点对应温度下,原料组成为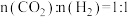 ,在初始总压为100kPa的1L恒容密闭容器中进行上述三个反应,体系达到平衡时CO的分压为30kPa,则
,在初始总压为100kPa的1L恒容密闭容器中进行上述三个反应,体系达到平衡时CO的分压为30kPa,则 的平衡转化率为
的平衡转化率为___________ 。
(3)维持压强和投料不变,将 和
和 按一定流速通过反应器,相同时间内测得二氧化碳的转化率
按一定流速通过反应器,相同时间内测得二氧化碳的转化率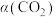 和甲醇的选择性
和甲醇的选择性 随温度变化的关系如图所示:
随温度变化的关系如图所示:
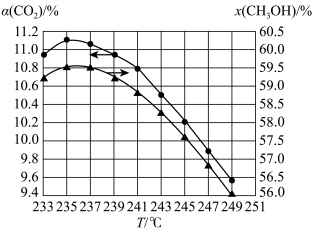
已知233~249℃内催化剂活性受温度影响变化不大。结合反应ⅰ和反应ⅱ,分析235℃后甲醇的选择性随温度升高而下降的原因是___________ ,二氧化碳的转化率随温度升高也在下降的可能原因是___________ 。
(1)
 作为未来的重要碳源,其选择性加氢合成
作为未来的重要碳源,其选择性加氢合成 一直是研究热点。在
一直是研究热点。在 加氢合成
加氢合成 的体系中,同时发生以下反应:
的体系中,同时发生以下反应:反应ⅰ:
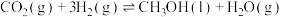

反应ⅱ:


反应ⅲ:
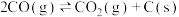

若某容器中同时发生上述反应ⅰ、ⅱ、ⅲ,一定条件下建立平衡后,下列说法正确的是___________(填序号)。
| A.反应ⅱ的平衡常数为1 |
| B.增加少量碳,反应ⅲ逆向移动 |
| C.反应ⅱ反应前后气体分子数不变,故增大该容器的压强对反应ⅱ的平衡无影响 |
D.选用合适的催化剂可提高 在单位时间内的产量 在单位时间内的产量 |
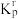 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以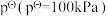 。反应ⅰ、ⅱ、ⅲ的
。反应ⅰ、ⅱ、ⅲ的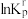 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应ⅰ、ⅱ、ⅲ中,正反应活化能小于逆反应活化能的反应有
②反应ⅰ的相对压力平衡常数表达式为

③在A点对应温度下,原料组成为
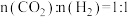 ,在初始总压为100kPa的1L恒容密闭容器中进行上述三个反应,体系达到平衡时CO的分压为30kPa,则
,在初始总压为100kPa的1L恒容密闭容器中进行上述三个反应,体系达到平衡时CO的分压为30kPa,则 的平衡转化率为
的平衡转化率为(3)维持压强和投料不变,将
 和
和 按一定流速通过反应器,相同时间内测得二氧化碳的转化率
按一定流速通过反应器,相同时间内测得二氧化碳的转化率 和甲醇的选择性
和甲醇的选择性 随温度变化的关系如图所示:
随温度变化的关系如图所示:
已知233~249℃内催化剂活性受温度影响变化不大。结合反应ⅰ和反应ⅱ,分析235℃后甲醇的选择性随温度升高而下降的原因是
您最近一年使用:0次
名校
解题方法
6 . 能源开发和利用是科学研究的热点课题。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
II.2CH3OH(g) CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2
III.CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=___________ (用含△H1、△H2、△H3的代数表示)。
(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
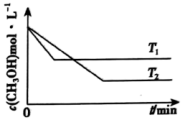
①△H___________ (填“>”“<”或“=”)0,说明理由___________ 。
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率___________ (填“增大”“减小”或“不变”)。
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g) CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为___________ 。
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡___________ (填“向左移动”、“向右移动”或“不移动”)。
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1
III.CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为___________ mol·L-1(用含a、b、V的代数式表示,下同),反应III的平衡常数为___________ 。
(1)几个有关CO的热化学方程式如下:
I.CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1II.2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2
CH3OCH3(g)+H2O(g) △H2III.CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3则3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g) △H=
CH3OCH3(g)+CO2(g) △H=(2)在1 L恒容密闭容器中充入一定量CH3OH发生反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
CH3OCH3(g)+H2O(g) △H,测得CH3OH的浓度与温度的关系如图所示:
①△H
②在T1时达到平衡后,再向容器中充入少量甲醇蒸气,CH3OH的平衡转化率
(3)工业上,利用水煤气合成CH3OH的反应表示如下:2H2(g)+CO(g)
 CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。
CH3OH(g) △H=-91.0 kJ·mol-1,向1 L的恒容密容器中加入0.1 mol H2和0.05 mol CO在一定温度下发生上述反应,10 min后反应达到平衡状态,测得放出的热量为3.64 kJ。①从反应开始恰好平衡状态时,H2的平均反应速率v(H2)为
②在温度不变条件下,上述反应达到平衡后再向容器中充入0.01 mol H2和0.05 mol CH3OH(g)时,平衡
(4)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.5 kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) △H2=-90.4 kJ·mol-1
CH3OH(g) △H2=-90.4 kJ·mol-1III.CO2(g)+H2(g)
 CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3一定条件下,向体积为V L的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CH3OH(g)为a mol,CO为b mol,此时H2O(g)的浓度为
您最近一年使用:0次
2021-07-02更新
|
1679次组卷
|
7卷引用:广西河池市九校2020-2021学年高二下学期第二次联考化学试题
广西河池市九校2020-2021学年高二下学期第二次联考化学试题重庆市缙云教育联盟2021-2022学年高三10月质量检测化学试题(已下线)第2章 化学反应速率和化学平衡(提分小卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)(已下线)2.2.3 影响化学平衡的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)第二章 化学反应速率与化学平衡(B卷·能力提升练)【单元测试】2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修1)河南宏力学校2021-2022学年高二上学期期中考试化学试题浙江省杭师大附中2022-2023学年高二上学期期中考试 化学试题
名校
解题方法
7 . 甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) ∆H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) ∆H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是___ 。
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式____ 。LiAlH4在化学反应中通常作_______ (填“氧化”或“还原”)剂。工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为 _________
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
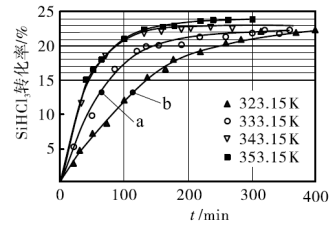
①353.15K时,平衡转化率为____ ,该反应是____ 反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是____ 。
(4)比较a、b处反应速率的大小:Va___ Vb(填“>”“<”或“=”)。已知反应速率V正=K1x2SiHCl3,V逆=K2xSiH2Cl2xSiCl4,K1,K2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时K1/K2=____ (保留3位小数)。
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是___ ,其原因是____ 。已知:H2SiO3 :Ka1=2.0×10-10、Ka2=2.0×10-12、H2CO3 :Ka1=4.3×10-7,Ka2=5.6×10-11
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)=SiCl4(g)+2H2(g) ∆H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) ∆H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是
(2)铝锂形成化合物LiAlH4既是金属储氢材料又是有机合成中的常用试剂,遇水能得到无色溶液并剧烈分解释放出H2,请写出其水解反应化学方程式
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为
②323.15K时,要缩短反应达到平衡的时间,可采取的最佳措施是
(4)比较a、b处反应速率的大小:Va
(5)硅元素最高价氧化物对应的水化物是H2SiO3,室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是
您最近一年使用:0次
2020-04-02更新
|
610次组卷
|
2卷引用:天津塘沽一中2020届高三3月网上测试化学试题
解题方法
8 . Ⅰ.汽车尾气中含有NO、CO等有害物质,其中NOx会引起光化学烟雾等环境问题。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因_________________ (用化学方程式表示,该反应为为可逆反应);汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因 _____________________________ 。
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为______________________________________ ;
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+ O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol
H2(g)+ O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/mol
CH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为___________ 。
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:
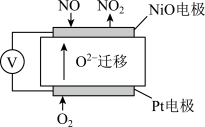
①Pt电极上发生的是______________ 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为______________________________________ ;
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
0~5min内,该反应的平均反应速率V(NO)=___________________ ;
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s) CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是__________________ (用含a的式子表示)。
NH3-SCR技术是去除NOx最为有效的技术之一:在催化剂条件下,以NH3或尿素将尾气中NOx还原为N2从而降低污染。
(1)汽车燃料中一般不含氮元素,汽缸中生成NO的原因
(2)①NH3去除尾气中的NOx,当v(NO):v(NO2)=1:1时称为“快速SCR 反应”,该反应化学方程式为
②合成NH3所用原料气H2,可用天然气为原料制得,有关反应能量变化如下所示。
CO(g)+
 O2(g)=CO2(g) △H1=-282.0 KJ/mol
O2(g)=CO2(g) △H1=-282.0 KJ/mol H2(g)+
 O2(g)=H2O(g) △H2=-241.8 KJ/mol
O2(g)=H2O(g) △H2=-241.8 KJ/molCH4(g)+2O2(g)=CO2(g)+ 2H2O(g) △H3=-836.3 KJ/mol
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为
(3)通过NOx传感器可监测NOx的含量,其工作原理如图所示,则:

①Pt电极上发生的是
②NiO电极上的电极反应式为
(4)研究发现,将煤炭在O2/CO2的气氛下燃烧,能够降低燃煤时NO的排放,主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于2L的恒容密闭容器中充入0.1molNO和0.3molCO发生该反应,测得不同时间容器内的压强(p)与起始压强(p0)的比值(p/p0)如下表。
| 时间/t | 0min | 2min | 5min | 10min | 13min | 15min |
| 比值(p/p0) | 1 | 0.97 | 0.925 | 0.90 | 0.90 | 0.90 |
0~5min内,该反应的平均反应速率V(NO)=
(5)将上述反应的CO2与NH3为原料合成尿素,能够实现节能减排:①2NH3(g)+CO2(g)=NH2CO2NH4(s);②NH2CO2NH4(s)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为aPa,若反应温度不变,将体系的体积增加50%,至达新平衡的过程中P[H2O(g)]的取值范围是
您最近一年使用:0次



