解题方法
1 . 下列实验方案设计、现象和结论正确的是
| 选项 | 实验目的 | 方案与现象 | 结论 |
| A | 探究反应物浓度对化学平衡的影响 | 向 的 的 溶液,再滴加10滴 溶液,再滴加10滴 的 的 溶液,溶液由黄色变为橙色 溶液,溶液由黄色变为橙色 | 说明增大氢离子浓度,平衡向生成 的方向移动 的方向移动 |
| B | 探究其他离子对化学平衡的影响 | 向 溶液中加入2滴 溶液中加入2滴 溶液,产生血红色,再加入少量 溶液,产生血红色,再加入少量 溶液后血红色变浅 溶液后血红色变浅 | 说明钾离子对该平衡有一定的抑制作用 |
| C | 判断水解常数大小: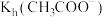 与 与 | 室温下,用 计分别测量等浓度的 计分别测量等浓度的 和 和 溶液的 溶液的 ,前者大于后者 ,前者大于后者 | 水解常数大小: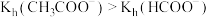 |
| D | 探究 和 和 在水溶液中的反应 在水溶液中的反应 | 向 溶液中滴加 溶液中滴加 溶液,有白色浑浊出现,并产生气体 溶液,有白色浑浊出现,并产生气体 | 说明 和 和 在相互促进水解 在相互促进水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 锶( )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为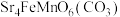 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化: 均不能形成配合物。请回答:
均不能形成配合物。请回答:
(1)写出溶液C中的所有阳离子___________ 。
(2)步骤Ⅴ中的反应为 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②___________ 。
(3)下列说法不正确 的是___________。
(4)固体Y可与 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式___________ 。
(5)设计实验方案检验气体中除 以外的两种主要成分
以外的两种主要成分___________ 。
 )与钙同主族,某固态化合物Y的组成为
)与钙同主族,某固态化合物Y的组成为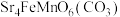 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化:
 均不能形成配合物。请回答:
均不能形成配合物。请回答:(1)写出溶液C中的所有阳离子
(2)步骤Ⅴ中的反应为
 ,说明
,说明 能够较完全转化为
能够较完全转化为 ,的两个原因分别是:①生成
,的两个原因分别是:①生成 降低了体系的能量,促使反应正向进行②
降低了体系的能量,促使反应正向进行②(3)下列说法
A.固体B中含有 | B.步骤Ⅱ反应促进了 的水解 的水解 |
C.步骤Ⅲ可推断碱性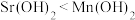 | D.直接加热 无法获得 无法获得 |
(4)固体Y可与
 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式(5)设计实验方案检验气体中除
 以外的两种主要成分
以外的两种主要成分
您最近一年使用:0次
名校
解题方法
3 . 根据实验目的设计方案并进行实验,观察到相关现象,其中方案设计或结论不正确 的是
| 实验目的 | 方案设计 | 现象 | 结论 | |
| A | 探究Fe和S反应特点 | 将适量硫粉和铁粉混合堆成条状。用灼热的玻璃棒触及一端,当混合物呈红热状态时,移开玻璃棒。 | 混合物继续保持红热并持续扩散,粉末呈黑色 | 该反应为放热反应 |
| B | 比较沉淀的Ksp大小 | 向相同浓度和体积的浓氨水中,分别加入等量AgCl和AgI固体,充分搅拌 | 氯化银溶解,碘化银无变化 | Ksp:AgCl>AgI |
| C | 判断平衡移动的方向 | 将装有NO2气体的注射器的活塞缓慢向外拉 | 红棕色逐渐变浅 | 可逆反应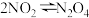 平衡正向移动 平衡正向移动 |
| D | 检验Na2S2O3样品是否含有Na2SO4杂质 | 取少量样品溶于水,先加入过量稀盐酸,过滤,向滤液中滴加少量BaCl2溶液 | 滤液中出现浑浊 | 该样品中含有Na2SO4杂质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . CH3CHO在NaOH溶液作用下制取2-丁烯醛的历程如下:
下列说法不正确 的是

下列说法
| A.OH-是该反应的催化剂 |
B.CH3CHO分子中甲基上的“ ”比 ”比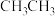 中的“ 中的“ ”更易电离出H+ ”更易电离出H+ |
| C.反应(4)加热失水有利于反应(3)平衡正向移动 |
| D.CH3CHO与CH3CH2CHO的混合液在NaOH溶液作用下最多可得到2种羟基醛 |
您最近一年使用:0次
2024-04-10更新
|
531次组卷
|
5卷引用:2024届浙江省嘉兴市高三下学期二模化学试题
2024届浙江省嘉兴市高三下学期二模化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题04 化学反应机理 历程 能垒图分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)选择题11-16湖北省沙市中学2024届高三下学期模拟预测化学试题
5 . 硝酸盐型熔盐(含 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: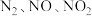 .
.
请回答:
(1)写出溶液A中的所有离子_________ ;方法Ⅱ中,“氧化吸收液”的目的是__________ .
(2)下列说法正确的是_________.
(3)方法Ⅰ中,用 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是_________ .
(4)在某温度下, 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂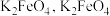 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素_________ .写出 与
与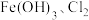 共热制取
共热制取 的化学方程式:
的化学方程式:_________ .
 )在太阳能光热发电领域被广泛应用.高纯
)在太阳能光热发电领域被广泛应用.高纯 的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下:
的制备、性质与应用是目前研究的热点,部分生产方法及性质研究如下: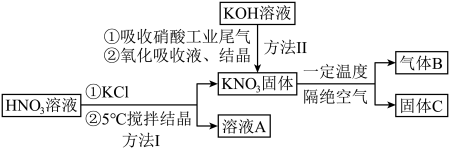
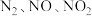 .
.请回答:
(1)写出溶液A中的所有离子
(2)下列说法正确的是_________.
A.方法Ⅰ说明:该条件下,酸性 |
B.方法Ⅱ中,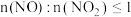 ,氮氧化物才能被足量的 ,氮氧化物才能被足量的 溶液充分吸收 溶液充分吸收 |
C. 固体与浓硫酸共热,可产生红棕色气体 固体与浓硫酸共热,可产生红棕色气体 |
| D.若气体B是一种单质,则所得固体C中不能含有三种元素 |
(3)方法Ⅰ中,用
 代替
代替 ,得到副产品
,得到副产品 .工业上用
.工业上用 溶液浸取菱镁矿的煅烧粉(含
溶液浸取菱镁矿的煅烧粉(含 ),不断加热蒸出氨气,以获得较高浓度的
),不断加热蒸出氨气,以获得较高浓度的 溶液,其原理是
溶液,其原理是(4)在某温度下,
 分解得到的
分解得到的 可用于制备新型高效多功能水处理剂
可用于制备新型高效多功能水处理剂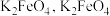 水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素
水溶液放置过程中会放出无色无味气体、产生沉淀、溶液呈强碱性.请依据上述信息,设计实验检验无色无味气体成分和沉淀中的金属元素 与
与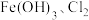 共热制取
共热制取 的化学方程式:
的化学方程式:
您最近一年使用:0次
2024-04-01更新
|
522次组卷
|
5卷引用:2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题
2024届浙江省温州市高三下学期第二次适应性考试(二模)化学试题浙江省温州市普通高中2024届高三下学期第二次适应性考试(二模)化学试题(已下线)化学(浙江卷01)-2024年高考押题预测卷(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)(已下线)压轴题11?无机化工流程综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
6 . 已知难溶性化合物 的化学式为
的化学式为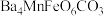 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。
(1) 高温下在
高温下在 气流中的反应
气流中的反应________ 氧化还原反应(填“属于”或“不属于”), 中钡元素的化合价为
中钡元素的化合价为________ 。
(2)步骤Ⅳ可以进行的原因除了生成 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因________ 。
(3)下列说法正确的是________。
(4)固体 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式________ 。
(5)设计实验检验混合气体A(除 外)的成份
外)的成份________ 。
 的化学式为
的化学式为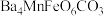 ,对
,对 进行如下实验,部分产物已经略去。
进行如下实验,部分产物已经略去。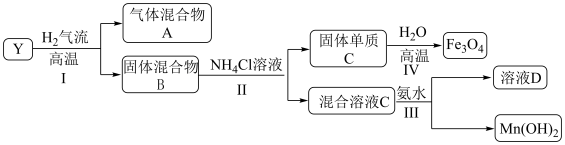
 中的金属元素在该实验条件下不能与
中的金属元素在该实验条件下不能与 产生配合物。
产生配合物。(1)
 高温下在
高温下在 气流中的反应
气流中的反应 中钡元素的化合价为
中钡元素的化合价为(2)步骤Ⅳ可以进行的原因除了生成
 降低体系的能量之外,从化学平衡的角度解释能够发生的原因
降低体系的能量之外,从化学平衡的角度解释能够发生的原因(3)下列说法正确的是________。
A.溶液D中阳离子只有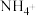 |
| B.若磁铁能吸引反应Ⅳ的剩余固体,则证明铁有剩余 |
| C.步骤Ⅱ中的氯化铵溶液也可以用盐酸代替 |
D.依据步骤Ⅲ可知碱性强弱 |
(4)固体
 在一定条件下也可以与
在一定条件下也可以与 溶液反应,写出反应的离子方程式
溶液反应,写出反应的离子方程式(5)设计实验检验混合气体A(除
 外)的成份
外)的成份
您最近一年使用:0次
名校
7 . 氯化钠应用广泛,下列说法正确的是
A.侯氏制碱法是将足量 通入氨化的氯化钠饱和溶液中,析出 通入氨化的氯化钠饱和溶液中,析出 晶体 晶体 |
| B.氯碱工业采用阴离子交换膜电解槽电解饱和食盐水获得氯气和氢氧化钠 |
| C.用洗净的铂丝蘸取某样品在酒精灯上灼烧,火焰呈黄色,该样品一定是钠盐 |
| D.向饱和氯化钠溶液中滴加浓盐酸能观察到固体析出 |
您最近一年使用:0次
2023-12-16更新
|
246次组卷
|
3卷引用:浙江省诸暨市2024届高三12月适应性考试化学试题
浙江省诸暨市2024届高三12月适应性考试化学试题(已下线)专题02 元素化合物(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省杭州市西湖高级中学2024届高三下学期5月模拟预测化学试题
解题方法
8 . 下列实验装置,可以达到实验目的的是
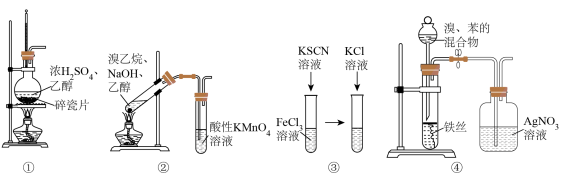
| A.用装置①在实验室制备乙烯 |
| B.用装置②证明溴乙烷消去反应有乙烯生成 |
C.用装置③探究KCl浓度是否对FeCl3+3KSCN Fe(SCN)3+3KCl的平衡移动有影响 Fe(SCN)3+3KCl的平衡移动有影响 |
| D.用装置④证明溴和苯发生的是取代反应而不是加成反应 |
您最近一年使用:0次
解题方法
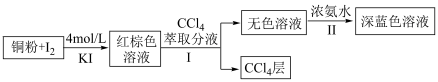
9 . 某小组设计实验探究铜被碘氧化的产物及铜元素的价态。 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);
②铜元素被氧化可能存在的形式有 (蓝色)、
(蓝色)、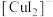 (无色);
(无色);
③ (无色),易被空气氧化。
(无色),易被空气氧化。
请回答:
(1)步骤Ⅰ中加入 萃取分液的目的是
萃取分液的目的是___________ 。
(2)用离子方程式表示步骤Ⅱ中发生的反应___________ 。
(3)已知 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为___________ 。
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因___________ 。
(已知: 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)
(5) 层呈
层呈___________ 色。如何设计实验将 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,___________ 。请补充完实验操作中涉及的离子方程式: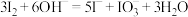 ,
,___________ 。
 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色);②铜元素被氧化可能存在的形式有
 (蓝色)、
(蓝色)、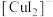 (无色);
(无色);③
 (无色),易被空气氧化。
(无色),易被空气氧化。请回答:
(1)步骤Ⅰ中加入
 萃取分液的目的是
萃取分液的目的是(2)用离子方程式表示步骤Ⅱ中发生的反应
(3)已知
 为白色不溶于水的固体,向
为白色不溶于水的固体,向 中加入浓
中加入浓 溶液,现象为
溶液,现象为(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因
(已知:
 稳定性远大于
稳定性远大于 (黄色),
(黄色), 稳定指的是不易发生解离反应
稳定指的是不易发生解离反应 )
)(5)
 层呈
层呈 层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将
层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将 层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液,
层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液, ,
,
您最近一年使用:0次
2023-10-09更新
|
232次组卷
|
4卷引用:浙江省强基联盟2023-2024学年高三上学期10月联考化学试题
浙江省强基联盟2023-2024学年高三上学期10月联考化学试题浙江强基联盟2023-2024学年第一学期高三年级10月联考 化学(已下线)专题08 工艺流程综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题11 无机化工流程综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
名校
10 . 氮是生命的基础,氮及其化合物在生产生活中具有广泛应用。工业上用氨的催化氧化生产硝酸,对于反应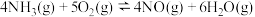 ,下列有关说法不正确的是
,下列有关说法不正确的是
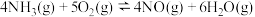 ,下列有关说法不正确的是
,下列有关说法不正确的是A.在容器中充入 和 和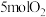 ,一定条件下充分反应,反应结束后,电子转移的物质的量小于 ,一定条件下充分反应,反应结束后,电子转移的物质的量小于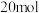 |
B.在恒容容器内,反应达到平衡后,通入 ,压强增大,则v(正)和v(逆)都增大 ,压强增大,则v(正)和v(逆)都增大 |
C.断裂 键的同时,断裂 键的同时,断裂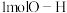 键,说明该反应达到平衡伏态 键,说明该反应达到平衡伏态 |
| D.当混合气体的平均摩尔质量不变,说明该反应达到平衡状态 |
您最近一年使用:0次



