真题
名校
1 . 某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入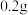 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知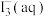 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入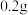 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知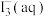 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |  在水中溶解度较小 在水中溶解度较小 |
| B | 溶液颜色加深 | 发生了反应: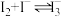 |
| C | 紫黑色晶体消失 |  ( ( )的消耗使溶解平衡 )的消耗使溶解平衡 右移 右移 |
| D | 溶液褪色 |  与有色物质发生了置换反应 与有色物质发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-13更新
|
8429次组卷
|
19卷引用:湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题
湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷10-2023新东方高二上期中考化学2023年高考辽宁卷化学真题(已下线)T13-实验方案的设计与评价(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 物质制备实验的设计与评价中国人民大学附属中学2023-2024学年高三下学期化学练习6(已下线)FHgkyldyjhx10福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题(已下线)测试辽宁化学 请勿下载2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)
2 . 近日,北京大学马丁团队报道了Pt/NiAl2O4界面催化剂上甲醇重整制氢反应的性质。化学反应原理:CH3OH(g)  CO(g) +2H2(g) ΔH >0 下列叙述正确的是
CO(g) +2H2(g) ΔH >0 下列叙述正确的是
 CO(g) +2H2(g) ΔH >0 下列叙述正确的是
CO(g) +2H2(g) ΔH >0 下列叙述正确的是| A.恒温恒容条件下,发生上述反应,平衡后充入氩气,反应速率增大 |
| B.恒温恒压条件下,发生上述反应,平衡后充入CH3OH(g),平衡不移动 |
| C.其他条件不变,加入Pt/NiAl2O4 ,能提高单位时间内H2的产率 |
| D.其他条件不变,升高温度,平衡常数和反应热(ΔH)都增大 |
您最近一年使用:0次
3 . 下列实验方法、操作均正确,且能达到实验目的的是
| 选项 | 实验目的 | 实验方法或操作 |
| A | 测定中和反应反应热 | 酸碱中和的同时,用铜质环形搅拌棒搅拌 |
| B | 判断反应后Ag+是否沉淀完全 | 将AgNO3溶液与NaCl溶液混合,反应后静置,向上层清液中再加入1滴NaCl溶液 |
| C | 探究压强对化学反应平衡移动的影响 | 容器中反应H2(g)+Br2(g)=2HBr(g)达平衡时,将容器压缩为原体积的 ,观察颜色变化 ,观察颜色变化 |
| D | 探究浓度对化学反应速率的影响 | 量取同体积不同浓度的盐酸,分别加入等体积、等浓度的NaOH溶液,对比现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 下列说法不符合勒夏特列原理的是
A.反应A2(g) + B2(g) 2AB(g),平衡后压缩容器,AB浓度增大 2AB(g),平衡后压缩容器,AB浓度增大 |
| B.密封保存碳酸饮料以防止CO2释放 |
| C.用饱和食盐水净化氯气以减少氯气溶于水 |
| D.酯化反应中增加醇的用量以提高酸的转化率 |
您最近一年使用:0次
2022-11-02更新
|
459次组卷
|
6卷引用:湖北省部分高中联考协作体2023-2024学年高二上学期期中考试化学试题
名校
解题方法
5 . 某温度下,改变0.1mol/LK2Cr2O7溶液的pH时,各种含铬元素微粒及OH-浓度变化如图所示(已知H2CrO4是二元酸),下列有关说法中正确的是


| A.该温度下的Kw=10-13 |
B.溶液中存在平衡 +H2O⇌2 +H2O⇌2 +2H+,该温度下此反应的K=10-13.2 +2H+,该温度下此反应的K=10-13.2 |
| C.向0.1mol/LK2Cr2O7溶液中加入一定量NaOH固体,溶液橙色加深 |
D.E点溶液中存在:c(K+)<2c( )+3c( )+3c( ) ) |
您最近一年使用:0次
2022-04-29更新
|
788次组卷
|
4卷引用:湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题
湖北省武汉外国语学校2022-2023学年高二上学期期末考试化学试题 辽宁省沈阳市同泽中学2022-2023学年高二12月月考化学试题东北三省四城市联考暨沈阳市2021-2022学年高三质量监测(二)化学试题(已下线)专项13 水溶液中的离子平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)
6 . 在密闭容器中进行如下反应
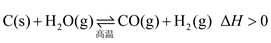
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡____________ ,c(H2O)___________ 。
(2)保持反应容器体积和温度不变,通入He,平衡____________ ,c(H2)____________ 。
(3)在一定温度下,缩小反应容器体积,平衡向____________ 方向移动,c(CO)___________ ,H2O(g)的转化率
______________ 。
(4)保持反应容器体积不变,升高温度,平衡向_________ 方向移动,c(H2)___________ 。
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向__________ 方向移动,H2O(g)的转化率
_________ ,c(CO)___________ 。
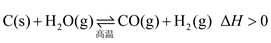
达平衡后,改变下列条件,用“正反应”“逆反应”或“不移动”分析判断平衡移动情况,用“增大”“减小”或“不变”分析判断物质的量变情况:
(1)增加C的含量,平衡
(2)保持反应容器体积和温度不变,通入He,平衡
(3)在一定温度下,缩小反应容器体积,平衡向

(4)保持反应容器体积不变,升高温度,平衡向
(5)保持反应容器体积和温度不变,再通入H2O(g),平衡向

您最近一年使用:0次
2021-11-07更新
|
313次组卷
|
2卷引用:湖北省十堰市六校协作体2022-2023学年高二上学期10月月考化学试题
解题方法
7 . 下列实验方案设计中,能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究浓度对平衡移动的影响 | 对于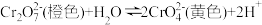 ,取两支试管各加入5mL0.1mol·L-1K2Cr2O7溶液,滴加3~10滴浓硫酸,溶液黄色加深 ,取两支试管各加入5mL0.1mol·L-1K2Cr2O7溶液,滴加3~10滴浓硫酸,溶液黄色加深 |
| B | 检验绿茶中是否含有酚类物质 | 取少量茶水于试管中,向其中滴加FeCl3溶液,观察溶液是否显紫色 |
| C | 验证溶度积:Ksp[Cu(OH)2]<Ksp[Mg(OH)2] | 取一支试管装入2mL2mol/LNaOH溶液,先滴加1mL1mol/LMgCl2溶液,再滴加几滴1mol/LCuCl2溶液,先生成白色沉淀,后沉淀变为蓝色 |
| D | 苯甲酸的重结晶实验 | 苯甲酸的溶解度随温度的降低而减小,故趁热过滤后,为了析出更多晶体,热滤液可用冰盐水充分冷却,同时缩短了结晶时间,所以温度越低越有利于苯甲酸的重结晶 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
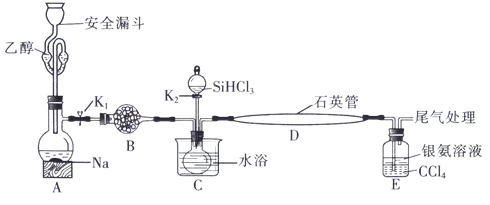
8 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为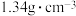 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加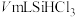 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为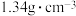 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
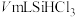 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:湖北省2020-2021学年高二下学期7月统一调研测试化学试题



