名校
1 . 某小组探究含Cr元素的化合物间的转化,进行如下实验。
资料:
i.含Cr元素的常见粒子: (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、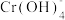 (亮绿色)。
(亮绿色)。
ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
(1)已知 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:_____ 。
(2)I中,溶液由橙色变为绿色的总反应的离子方程式是_____ 。
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是_____ 。
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:______ 。然后滴入NaOH溶液,有蓝灰色沉淀生成,继续滴入NaOH溶液,沉淀溶解,溶液变为______ 色。
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。
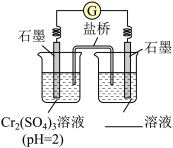
右侧烧杯的溶液中,氧化剂是_____ 。
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为_____ 。
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为_____ 。
(5)由上述实验, 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):
酸性条件下,
_____ H2O2;碱性条件下, 
_____ H2O2。
资料:
i.含Cr元素的常见粒子:
 (橙色)、
(橙色)、 (黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、
(黄色)、CrO5(溶于水,蓝紫色,不稳定)、Cr3+(绿色)、Cr(OH)3(蓝灰色,难溶于水,可溶于强酸、强碱)、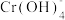 (亮绿色)。
(亮绿色)。ii.H2O2在碱性环境中比在酸性环境中分解速率快。
iii.在碱性环境中,O2不能氧化+3价铬元素。
实验操作及现象如表:
| 装置 | 步骤 | 操作 | 现象 |
 2mL0.0125mol•L-1K2Cr2O7溶液 | I | 先滴入稀硫酸至pH≈2,再滴入5滴5%H2O2溶液,振荡 | 溶液橙色加深。滴入H2O2溶液后迅速变为蓝紫色,有气泡生成。稍后,无明显气泡时,溶液由蓝紫色完全变为绿色 |
| Ⅱ | 继续缓慢滴入10滴2mol•L-1NaOH溶液,边滴,边振荡 | 又有气泡生成,溶液最终变为黄色 |
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:
(黄色)+2H+。请用化学平衡移动原理解释I中滴入稀硫酸后溶液橙色加深的原因:(2)I中,溶液由橙色变为绿色的总反应的离子方程式是
(3)Ⅱ中,继续滴入NaOH溶液后,又有气泡生成的原因是
(4)Ⅱ中,继续滴入NaOH溶液后,预测有Cr(OH)3沉淀生成,但实验时未观察到。
提出假设:在碱性环境中,+3价铬元素被H2O2氧化。
①甲同学设计实验证明假设成立:
取少量I中的绿色溶液,在滴入NaOH溶液前增加一步操作:
②乙同学进一步研究碱性环境对+3价铬元素的还原性或H2O2的氧化性的影响,设计如图实验。

右侧烧杯的溶液中,氧化剂是
开始时灵敏电流计指针不偏转,分别继续进行如下实验。
i.向左侧烧杯中滴入NaOH溶液,出现蓝灰色沉淀,继续缓慢滴入NaOH溶液,灵敏电流计指针向右偏转(电子从左向右运动),此时左侧的电极反应式为
ii.向右侧烧杯中滴入NaOH溶液,有微小气泡生成,灵敏电流计指针向左偏转,左侧无明显变化。此时原电池中的总反应的化学方程式为
(5)由上述实验,
 与H2O2、
与H2O2、 与H2O2的氧化性强弱(填“>”或“<”):
与H2O2的氧化性强弱(填“>”或“<”):酸性条件下,


您最近一年使用:0次
2023-01-07更新
|
408次组卷
|
4卷引用:北京市中关村中学2023-2024学年高二上学期期中考试化学试题
2 . 资料显示, 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。
将等体积的 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。
实验记录如下:
(1)基态 的电子排布式
的电子排布式___________ 。
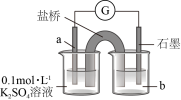
(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有 (蓝色)或
(蓝色)或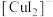 (无色),进行以下实验探究:
(无色),进行以下实验探究:
步骤a.取实验Ⅲ的深红棕色溶液,加入 ,多次萃取、分液。
,多次萃取、分液。
步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去 的原理是
的原理是___________ 。
ii.查阅资料, (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:___________ ,___________ 。
(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,___________ (填实验现象)。实验Ⅲ中铜被氧化的化学方程式是___________ 。
(4)上述实验结果, 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为___________ ,b试剂为___________ 。
 可以将
可以将 氧化为
氧化为 。某小组同学设计实验探究
。某小组同学设计实验探究 被
被 氧化的产物及铜元素的价态。已知:
氧化的产物及铜元素的价态。已知: 易溶于
易溶于 溶液,发生反应
溶液,发生反应 (红棕色);
(红棕色); 和
和 氧化性几乎相同。
氧化性几乎相同。将等体积的
 溶液加入到n
溶液加入到n 铜粉和m
铜粉和m
 (
( )的固体混合物中,振荡。
)的固体混合物中,振荡。实验记录如下:
 | 实验现象 | |
| 实验Ⅰ | 0.01 | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ | 0.1 | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ | 4 |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 的电子排布式
的电子排布式(2)实验Ⅲ所得溶液中,被氧化的铜元素的可能存在形式有
 (蓝色)或
(蓝色)或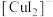 (无色),进行以下实验探究:
(无色),进行以下实验探究:步骤a.取实验Ⅲ的深红棕色溶液,加入
 ,多次萃取、分液。
,多次萃取、分液。步骤b.取分液后的无色水溶液,滴入浓氨水。溶液颜色变浅蓝色,并逐渐变深。
i.步骤a除去
 的原理是
的原理是ii.查阅资料,
 (无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:
(无色)容易被空气氧化,用两个离子方程式解释步骤b的溶液中发生的变化:(3)上述实验推测实验Ⅰ和Ⅱ中的白色沉淀可能是
 ,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入
,分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入 溶液,
溶液,(4)上述实验结果,
 仅将
仅将 氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了
氧化为+1价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
氧化为 。装置如图所示,a物质为
。装置如图所示,a物质为
您最近一年使用:0次
2023-11-03更新
|
274次组卷
|
2卷引用:湖北省鄂东南省级示范高中教育教学改革联盟学校2023-2024学年高三上学期期中联考化学试题
3 . 已知铁离子、氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如图实验探究其氧化性强弱:
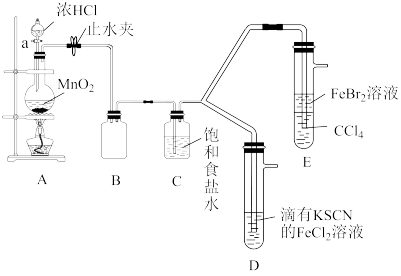
(1)装置A中发生反应的离子方程式是_______ 。
(2)整套实验装置存在一处明显的不足,请指出:_______ 。
(3)用改正后的装置进行实验,实验过程如表:
(4)因忙于观察和记录,没有及时停止反应,D、E中均发生新的变化。
D装置中:血红色慢慢褪去。
E装置中: 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料为:
①请用平衡移动原理(结合上述资料)解释 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:_______ 。
②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加_______ 溶液,若溶液颜色_______ ,则上述解释是合理的。
小组同学另查得资料为:
③欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:_______ 。

(1)装置A中发生反应的离子方程式是
(2)整套实验装置存在一处明显的不足,请指出:
(3)用改正后的装置进行实验,实验过程如表:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变血红色; E装置中:水层溶液变黄,振荡后,  层明显变化;一段时间后 层明显变化;一段时间后 | 氧化性由强到弱的顺序为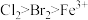 |
D装置中:血红色慢慢褪去。
E装置中:
 层颜色逐渐加深,直至变成红色。
层颜色逐渐加深,直至变成红色。为探究上述实验现象的本质,小组同学查得资料为:
ⅰ.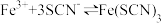 是一个可逆反应。 是一个可逆反应。ⅱ.  性质与卤素单质类似。氧化性: 性质与卤素单质类似。氧化性: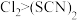 。 。 |
 过量时D中溶液血红色褪去的原因:
过量时D中溶液血红色褪去的原因:②现设计简单实验证明上述解释:取少量褪色后的溶液,滴加
小组同学另查得资料为:
ⅲ. 和 和 反应生成 反应生成 , , 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。ⅳ.  、 、 均可溶于水。 均可溶于水。 |
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入
 溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
溶液,结果观察到有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀的原因:
您最近一年使用:0次
名校
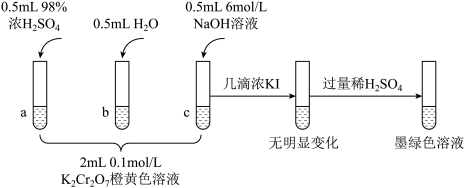
4 . 研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
已知:
资料1: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H=+13.8 kJ/mol;
(黄色)+2H+ △H=+13.8 kJ/mol;
资料2:+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是___________ 。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?___________ (填“是”或“否”),理由是___________ 。
(3)对比试管a、b、c的实验现象,可知c(H+)增加时,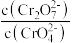
___________ (填“增大”,“减小”,“不变”)。
(4)试管c继续滴加KI溶液、过量稀H2SO4,写出此过程中氧化还原反应的离子方程式___________ 。

已知:
资料1:
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+ △H=+13.8 kJ/mol;
(黄色)+2H+ △H=+13.8 kJ/mol;资料2:+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?
(3)对比试管a、b、c的实验现象,可知c(H+)增加时,
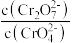
(4)试管c继续滴加KI溶液、过量稀H2SO4,写出此过程中氧化还原反应的离子方程式
您最近一年使用:0次
名校
解题方法
5 . 为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是_________________________________________________ 。
(2)棉花中浸润的溶液为________________________ 。
(3)A中发生反应的化学方程式为_______________________________________ 。
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是_______________________________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是____________________ (填“甲”“乙”“丙”)。
(6)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。查阅资料:Fe2+(aq) +  (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。
提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E为__________________ 。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因_____________

实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是
(2)棉花中浸润的溶液为
(3)A中发生反应的化学方程式为
(4)过程Ⅴ中,B溶液中发生反应的离子方程式是
(5)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2 > Fe3+ >SO2的是
| 过程ⅣB溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有 |
| 乙 | 既有Fe3+又有Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
 (aq)
(aq) FeSO3(s)(墨绿色)。
FeSO3(s)(墨绿色)。提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。某同学设计如下实验,证实该假设成立:

①溶液E为
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因
您最近一年使用:0次
2020-12-02更新
|
280次组卷
|
3卷引用:云南省昆明市第一中学2023-2024学年高二上学期期中化学试题
名校
解题方法
6 . 某实验小组对 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。
实验药品: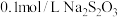 溶液(
溶液( );
);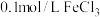 溶液(
溶液( );
);
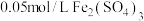 溶液(
溶液( )。
)。
实验过程
资料:ⅰ. 在酸性条件下不稳定,发生反应
在酸性条件下不稳定,发生反应 :
:
ⅱ. (暗紫色),
(暗紫色), 遇
遇 无明显现象
无明显现象
(1)配制 溶液时,需要用盐酸酸化,结合离子方程式解释原因:
溶液时,需要用盐酸酸化,结合离子方程式解释原因:_____ 。
(2)对实验I中现象进行分析:
①查阅资料: 可将
可将 氧化成
氧化成 ,反应的离子方程式是
,反应的离子方程式是_____ 。
②结合反应速率与平衡移动原理解释实验中先出现紫色,后紫色褪去的原因_____ 。
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_____
②由实验Ⅳ和实验Ⅴ得出的结论是_____ 。
 分别与
分别与 、
、 的反应进行实验探究。
的反应进行实验探究。实验药品:
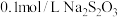 溶液(
溶液( );
);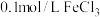 溶液(
溶液( );
);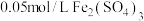 溶液(
溶液( )。
)。实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |  | 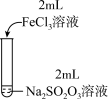 | 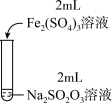 |
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色褪去,久置后不出现淡黄色浑浊 | 溶液呈紫色,静置后紫色缓慢褪去,久置后不出现淡黄色浑浊 |
 在酸性条件下不稳定,发生反应
在酸性条件下不稳定,发生反应 :
:ⅱ.
 (暗紫色),
(暗紫色), 遇
遇 无明显现象
无明显现象(1)配制
 溶液时,需要用盐酸酸化,结合离子方程式解释原因:
溶液时,需要用盐酸酸化,结合离子方程式解释原因:(2)对实验I中现象进行分析:
①查阅资料:
 可将
可将 氧化成
氧化成 ,反应的离子方程式是
,反应的离子方程式是②结合反应速率与平衡移动原理解释实验中先出现紫色,后紫色褪去的原因
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 |  | 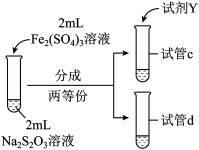 |
| 实验现象 | 紫色褪去时间 | 紫色褪去时间 |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
7 . 请阅读下列信息:
①铬( )元素在溶液中主要以
)元素在溶液中主要以 (绿色)、
(绿色)、 (橙色)、
(橙色)、 (黄色)等形式存在
(黄色)等形式存在
②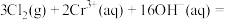

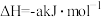
③
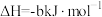
④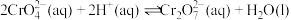
 平衡常数
平衡常数
⑤上述a、b、c均大于0,完成下列问题:
I.对于离子反应: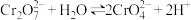 。某小组用
。某小组用 溶液进行下列实验:
溶液进行下列实验:

(1)①中实验现象:溶液___________ 加深,③中实验现象:溶液___________ 加深。
(2)对比②和④可知
___________ (填“酸性”或“碱性”)溶液氧化性较强。
(3)若向④中加入70% 溶液至过量,溶液颜色最后变为
溶液至过量,溶液颜色最后变为___________ 。
II.对反应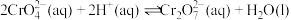 ,取
,取 溶液进行实验,部分测定数据如下:
溶液进行实验,部分测定数据如下:
(4) 到
到 之间用
之间用 表示该反应的平均反应速率为
表示该反应的平均反应速率为___________ 。
(5) 时溶液的
时溶液的
___________ 。
(6)已知在酸性条件下 将
将 氧化为
氧化为 ,本身被还原为
,本身被还原为 为放热反应,试写出该反应的热化学方程式:
为放热反应,试写出该反应的热化学方程式:___________ 。
①铬(
 )元素在溶液中主要以
)元素在溶液中主要以 (绿色)、
(绿色)、 (橙色)、
(橙色)、 (黄色)等形式存在
(黄色)等形式存在②
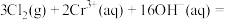

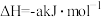
③

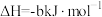
④
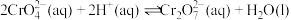
 平衡常数
平衡常数
⑤上述a、b、c均大于0,完成下列问题:
I.对于离子反应:
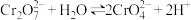 。某小组用
。某小组用 溶液进行下列实验:
溶液进行下列实验:
(1)①中实验现象:溶液
(2)对比②和④可知

(3)若向④中加入70%
 溶液至过量,溶液颜色最后变为
溶液至过量,溶液颜色最后变为II.对反应
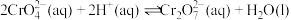 ,取
,取 溶液进行实验,部分测定数据如下:
溶液进行实验,部分测定数据如下:| 时间(s) | 0 |  |  |  |  |
 |  |  |  |  | |
 | 0 |  |  |
 到
到 之间用
之间用 表示该反应的平均反应速率为
表示该反应的平均反应速率为(5)
 时溶液的
时溶液的
(6)已知在酸性条件下
 将
将 氧化为
氧化为 ,本身被还原为
,本身被还原为 为放热反应,试写出该反应的热化学方程式:
为放热反应,试写出该反应的热化学方程式:
您最近一年使用:0次
名校
8 . 铬是不锈钢中一种重要的元素,铬的毒性与其存在的价态有关,低价铬对人体基本无害,六价铬比三价铬毒性高100倍,并易被人体吸收且在体内蓄积,有关含铬化合物的相互转化关系如图甲。
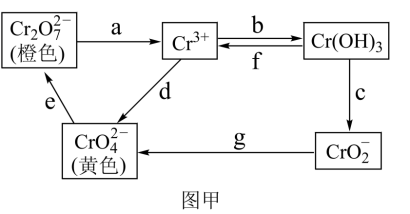
回答下列问题:
(1)从图甲中信息判断,Cr(OH)3是___________ 氢氧化物(填“酸性”、“碱性”或“两性”),相关反应的离子方程式为___________ 。
(2)图甲中所示转化过程中需要加入氧化剂的是___________ (填写表示转化过程的小写字母)。
(3)在水溶液中橙色的 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O
+H2O 2
2 +2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是
+2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是___________ 。
(4)CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率( )随温度的变化如图乙所示。
)随温度的变化如图乙所示。
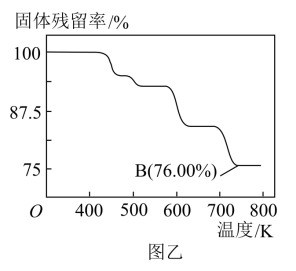
①三氧化铬在稀硫酸环境中氧化乙醇,CrO3变为绿色的Cr2(SO4)3,乙醇被完全氧化为CO2,则其化学方程式是___________ 。
②图乙中B点所示固体的化学式是___________ 。

回答下列问题:
(1)从图甲中信息判断,Cr(OH)3是
(2)图甲中所示转化过程中需要加入氧化剂的是
(3)在水溶液中橙色的
 与黄色的
与黄色的 有下列平衡关系:
有下列平衡关系: +H2O
+H2O 2
2 +2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是
+2H+。向K2Cr2O7稀溶液中加入NaOH溶液后,溶液颜色的变化是(4)CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率(
 )随温度的变化如图乙所示。
)随温度的变化如图乙所示。
①三氧化铬在稀硫酸环境中氧化乙醇,CrO3变为绿色的Cr2(SO4)3,乙醇被完全氧化为CO2,则其化学方程式是
②图乙中B点所示固体的化学式是
您最近一年使用:0次
9 . 高锰酸钾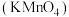 和双氧水
和双氧水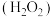 都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下面问题:
都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下面问题:
(1)H2O2是一种二元弱酸,与 反应的化学方程式为
反应的化学方程式为 ,写出H2O2的电离方程式
,写出H2O2的电离方程式_______ (只写第一步)。在酸性条件下H2O2的分解速度变大,利用平衡移动的原理进行解释:_______ 。
(2)新型甲醇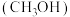 和O2燃料电池,利用甲醇和水做燃料,装置如下图所示:
和O2燃料电池,利用甲醇和水做燃料,装置如下图所示:
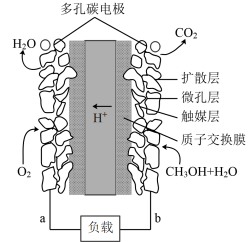
①a处的多孔碳电极是_______ (填“正极”或“负极”),发生的电极反应是_____ 。
②b处的多孔碳电极上发生的电极反应____ 。有1mol甲醇发生反应转移的质子数是_____  。
。
(3)现有 燃料电池,装置如下图所示:
燃料电池,装置如下图所示:
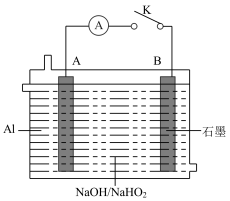
①关闭电键K,电流表指针发生偏转。A电极是Al,写出A电极的电极反应式_______ ,反应后B电极区溶液的pH_______ (填“增大”“减小”或“不变”)。
②电子从_______ 电极流向_______ 电极(填“A”或“B”)。
(4)某化学兴趣小组为了探究KMnO4与H2O2氧化性强弱,设计了如下实验装置:
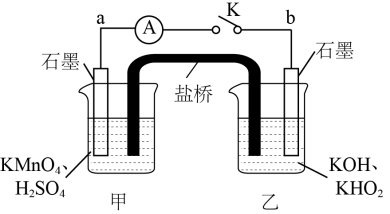
①当闭合电键K时,电流表指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生_______ 反应(填“氧化”或“还原”),石墨电极b上发生的电极反应为_______ 。
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流表指针逐渐翻转,最后向右偏转,说明KMnO4与H2O2氧化性与_______ 有关。
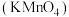 和双氧水
和双氧水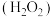 都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下面问题:
都是常见的消毒试剂,在日常生活和工业生产中都有广泛的应用。回答下面问题:(1)H2O2是一种二元弱酸,与
 反应的化学方程式为
反应的化学方程式为 ,写出H2O2的电离方程式
,写出H2O2的电离方程式(2)新型甲醇
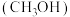 和O2燃料电池,利用甲醇和水做燃料,装置如下图所示:
和O2燃料电池,利用甲醇和水做燃料,装置如下图所示:
①a处的多孔碳电极是
②b处的多孔碳电极上发生的电极反应
 。
。(3)现有
 燃料电池,装置如下图所示:
燃料电池,装置如下图所示:
①关闭电键K,电流表指针发生偏转。A电极是Al,写出A电极的电极反应式
②电子从
(4)某化学兴趣小组为了探究KMnO4与H2O2氧化性强弱,设计了如下实验装置:

①当闭合电键K时,电流表指针向左偏转,甲烧杯中溶液颜色逐渐变浅,则石墨电极a上发生
②反应一段时间后,向甲烧杯中滴加KOH溶液,同时向乙烧杯中滴加硫酸溶液,发现电流表指针逐渐翻转,最后向右偏转,说明KMnO4与H2O2氧化性与
您最近一年使用:0次
名校
解题方法
10 . 某小组以FeCl3溶液为研究对象,探究物质之间反应的多样性,进行了如下实验。
Ⅰ.探究FeCl3溶液中的离子平衡和离子反应。
(1)配制50 mL 1.0 mol/L的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol/L。
①用化学用语解释FeCl3溶液呈酸性的原因___________ 。
②下列实验方案中,能使FeCl3溶液pH升高的是___________ 。
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
已知:Zn的性质与Al相似,能发生反应:Zn+2NaOH=Na2ZnO2+H2↑。
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因___________ 。
②用离子方程式解释反应后溶液为浅绿色的原因___________ 。
(3)为进一步探究上述1.0 mol/L FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
小组同学得出结论:在1.0mol/L FeCl3溶液中,Fe3+的氧化性比H+更强。
Ⅱ.探究FeCl3溶液与碱性物质之间的反应。
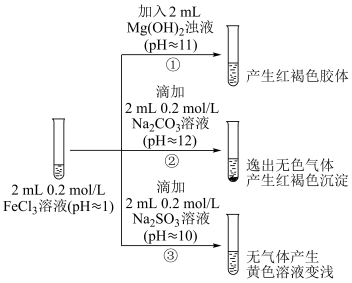
(4)②中逸出的无色气体是___________ (写化学式)。
(5)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
ⅰ.甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是___________ 。
ⅱ.乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是___________ 。
(6)受上述实验启发,小组同学对pH≈8的1mol/L NaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
i.⑤的实验目的是___________ 。
ⅱ.为探究④中溶液变无色的原因,进行了如下实验:

资料显示: FeF3溶液为无色。
请用化学平衡移动原理解释红褐色沉淀产生的原因___________ 。
(7)根据以上实验,FeCl3溶液与碱性物质之间反应的多样性与___________ 有关。
Ⅰ.探究FeCl3溶液中的离子平衡和离子反应。
(1)配制50 mL 1.0 mol/L的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol/L。
①用化学用语解释FeCl3溶液呈酸性的原因
②下列实验方案中,能使FeCl3溶液pH升高的是
a.加水稀释 b.加入FeCl3固体 c.滴加浓KSCN溶液 d.加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
| 操作 | 现象 |
| 向反应瓶中加入6.5g锌粉,然后加入50mL 1.0 mol/L的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色 |
| 收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因
②用离子方程式解释反应后溶液为浅绿色的原因
(3)为进一步探究上述1.0 mol/L FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
| 操作 | 现象 |
| 将5 mL 1.0 mol/L的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
| 将 | 溶液中立即产生大量气泡 |
Ⅱ.探究FeCl3溶液与碱性物质之间的反应。

(4)②中逸出的无色气体是
(5)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
ⅰ.甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
ⅱ.乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
(6)受上述实验启发,小组同学对pH≈8的1mol/L NaF溶液与FeCl3溶液混合时的现象产生了好奇并进行实验:
| 实验操作 及现象 | ④向2 mL 0.2 mol/LFeCl3溶液中滴入2 mL 1 mol/LNaF溶液,溶液变无色 |
| ⑤向2 mL 0.2 mol/LFeCl3溶液中滴入2 mL蒸馏水,溶液颜色变浅 |
ⅱ.为探究④中溶液变无色的原因,进行了如下实验:

资料显示: FeF3溶液为无色。
请用化学平衡移动原理解释红褐色沉淀产生的原因
(7)根据以上实验,FeCl3溶液与碱性物质之间反应的多样性与
您最近一年使用:0次



