1 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a)

b)

c)

d)

e)

(1)已知相关物质的燃烧热(25℃、101 kPa):
则△H1=___________ 。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为___________ ,原因是___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a)


b)


c)


d)


e)


(1)已知相关物质的燃烧热(25℃、101 kPa):
| 物质 | CH4(g) | CO(g) | H2(g) |
燃烧热(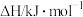 ) ) |  |  |  |
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.移去部分C(s),反应c、d、e的平衡均向右移动 |
| B.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |

(4)900℃下,将CH4和CO2的混合气体(投料比1:1)按一定流速通过盛有炭催化剂的反应器,测得CH4的转化率受炭催化剂颗粒大小的影响如图所示。(注:目数越大,表示炭催化剂颗粒越小)

由图可知,75 min后CH4转化率与炭催化剂目数的关系为
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
名校
解题方法
2 . 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水。

(1)还原沉淀法是处理含Cr2O 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第Ⅰ步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
①若平衡体系的pH=0,该溶液显___________ 色。
②根据2CrO +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为___________ ,图中右侧电极连接电源的___________ 极,其电极反应式为___________ 。
③第Ⅱ步反应的离子方程式:___________ 。
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□_______

(1)还原沉淀法是处理含Cr2O
 和CrO
和CrO 工业废水的一种常用方法,其工艺流程为:CrO
工业废水的一种常用方法,其工艺流程为:CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第Ⅰ步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O①若平衡体系的pH=0,该溶液显
②根据2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为
+H2O,设计如图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7。 Na2Cr2O7中铬元素的化合价为③第Ⅱ步反应的离子方程式:
(2)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。 完成该反应的化学方程式:
□CrO3+□C2H5OH+□H2SO4=□Cr2(SO4)3+□CH3COOH+□
您最近一年使用:0次
解题方法
3 . 重铬酸钠是一种用途极广的氧化剂,以铬铁矿[主要成分Fe(CrO2)2,含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体,同时回收Cr的主要工艺流程如图:
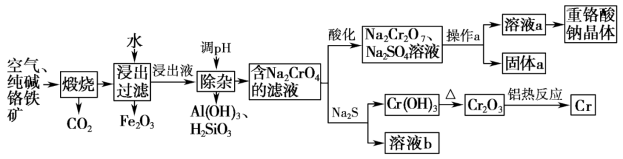
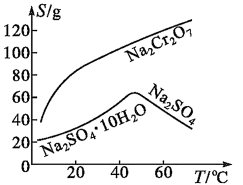
已知部分物质的溶解度曲线如图所示。
请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为___________ 。
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是___________ 。
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为___________ 。
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为___________ (结合离子方程式用平衡移动原理解释)。
(5)操作a的实验步骤为___________ 。
(6)加入Na2S溶液反应后,硫元素全部以S2O 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于___________ mol•L−1,CrO 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]

已知部分物质的溶解度曲线如图所示。

请回答下列问题:
(1)煅烧生成Na2CrO4的化学方程式为
(2)将Fe2O3溶于稀硫酸后得到对应盐溶液,检验该溶液中金属阳离子的方法是
(3)若通过加入稀硫酸调节溶液pH使铝元素转化为Al(OH)3,所发生反应的离子方程式为
(4)Na2CrO4经酸化转化为Na2Cr2O7的原理为
(5)操作a的实验步骤为
(6)加入Na2S溶液反应后,硫元素全部以S2O
 的形式存在,该反应中氧化剂和还原剂的物质的量之比为
的形式存在,该反应中氧化剂和还原剂的物质的量之比为(7)含铬废水会对环境造成污染,要经过化学处理才能排放。现将含CrO
 的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于
的废水加入可溶性钡盐生成BaCrO4沉淀,加入可溶性钡盐后,废水中Ba2+的浓度应不小于 才能沉淀完全[当溶液中c(CrO
才能沉淀完全[当溶液中c(CrO )≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
)≤1×10-5 mol•L−1时,可视作该离子沉淀完全,已知Ksp(BaCrO4)=1.2×10−10]
您最近一年使用:0次
名校
4 . 碳酸二甲酯【CO(OCH3)2】是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5 mol CH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是


| A.在该温度下,最佳反应时间是10h |
| B.4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1 |
| C.向反应体系中添加催化剂,一定能提高反应的TON |
| D.该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义 |
您最近一年使用:0次
2019-02-05更新
|
567次组卷
|
4卷引用:【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题
【全国百强校】浙江省嘉兴市第一中学2019届高三上学期期末考试化学试题(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP409】【化学】(已下线)【浙江新东方】99(鲁科版2019)必修第二册 第2章 化学键 化学反应规律 第3节 化学反应的快慢和限度 第1课时 化学反应的快慢



