名校
1 . 以含镓废料[主要成分为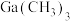 ]为原料制备半导体材料
]为原料制备半导体材料 的工艺如图所示。已知:
的工艺如图所示。已知: 和
和 的性质相似。下列叙述错误的是
的性质相似。下列叙述错误的是
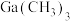 ]为原料制备半导体材料
]为原料制备半导体材料 的工艺如图所示。已知:
的工艺如图所示。已知: 和
和 的性质相似。下列叙述错误的是
的性质相似。下列叙述错误的是 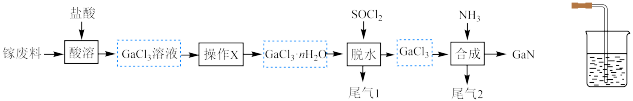
A.操作 不宜温度过高 不宜温度过高 |
B.用 固体可替代“脱水”中的 固体可替代“脱水”中的 |
C.用酸性 溶液可检验“脱水”产生的气体含 溶液可检验“脱水”产生的气体含 |
| D.不能用如图装置吸收“合成”中尾气 |
您最近一年使用:0次
2024-04-01更新
|
208次组卷
|
2卷引用:吉林省白山市2023-2024学年高三第二次模拟考试化学试题
解题方法
2 . 苯甲酸甲酯是一种无色透明油状液体,具有浓郁的冬青油香气,用于配制香水、香精,也可用作有机合成中间体、溶剂等。某实验小组以苯甲酸和甲醇为原料模拟工业合成苯甲酸甲酯,步骤如下:
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。
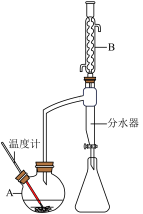
实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
请回答下列问题:
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为___________ 。
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是____________ ;但醇酸比超过5:1时,醇酸比的增加对产率影响不大,原因是___________ 。
(3)该实验的温度控制在85°C,应采取的加热方式为___________ 。
(4)实验中需多次将分水器中下层液体放出,其目的是___________ ,判断反应已经完成的标志是___________ 。
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入___________ (填字母),加入饱和食盐水的作用是___________ 。
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是___________ 。
Ⅰ.制备:向100mL如图所示的装置A中加入磁力搅拌子,然 后依次加入6.1 g苯甲酸、10 mL 95%甲醇、20 mL苯,微热将苯甲酸全部融化后,加入2.5克固体氯化铝催化剂。按如图所示组装好仪器,并预先在分水器内加入水至略低于支管口,加热回流4 h,直至反应基本完成。

实验过程中分水器得到的液体会分层,需多次开启分水器活塞将下层液体放出。
Ⅱ.分离提纯:待反应液冷却至室温后过滤掉氯化铝,将液体倒入盛有冷水的烧杯中,再经过一系列分离提纯操作,最后蒸馏收集196~199°C馏分,得到5.0 g产品。
可能用到的数据如下:
| 有机物名称 | 相对分子质量 | 密度/(g· cm-3) | 沸点/°C | 溶解性 |
| 苯甲酸 | 122 | 1.26 | 249 | 微溶于水,易溶于乙醇 |
| 甲醇 | 32 | 0.79 | 64.8 | 易溶于水 |
| 苯甲酸甲酯 | 136 | 1.08 | 198 | 难溶于水、易溶于乙醇 |
| 苯 | 78 | 0.88 | 80.1 | 难溶于水 |
(1)苯甲酸的沸点高于苯甲酸甲酯的原因为
(2)加料时,n(甲醇):n(苯甲酸)约为5:1,甲醇过量的原因是
(3)该实验的温度控制在85°C,应采取的加热方式为
(4)实验中需多次将分水器中下层液体放出,其目的是
(5)步骤Ⅱ中,“一系列分离提纯操作”过程中用到的试剂包括a.无水氯化钙,b.饱和食盐水,c.5% Na2CO3溶液。按操作先后顺序应依次加入
(6)传统制法用浓硫酸催化,浓硫酸催化具有活性高,价格低廉的优点,但现代工艺多以固体氯化铝作催化剂。这样改进最主要的原因是
您最近一年使用:0次
3 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=___________ kJ/mol。
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为___________ (保留2位有效数字)。
(4)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:

①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比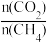 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:

随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=
(2)在恒容密闭容器中发生反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H<0。下列说法正确的是
| A.增大CO2的浓度,有利于NH3的转化率增大 |
| B.反应在任何温度下都能自发进行 |
| C.当混合气体的密度不再发生改变时反应达平衡状态 |
| D.充入He,压强增大,平衡向正反应移动 |
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)
2CO(g)+2H2(g)(3)反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为
(4)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(5)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) △H2=+41.0 kJ/mol,在刚性密闭容器中,进料比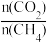 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次
4 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
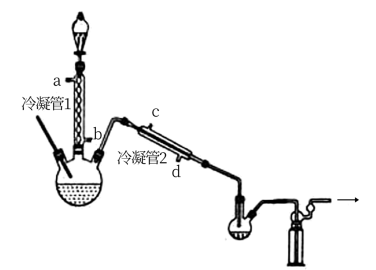
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2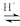
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI(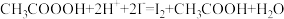 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(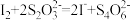 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
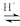
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
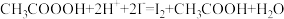 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去(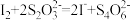 )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
5 . 2022年1月24日,习近平总书记在十九届中共中央政治局第三十六次集中学习时强调,实现碳达峰碳中和是贯彻新发展理念、构建新发展格局、推动高质量发展的内在要求。因此,二氧化碳的合理利用成为研究热点。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-159.5kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ/mol
总反应III:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3
反应III的ΔH3=________ kJ/mol,据此判断该反应在________ (填“低温”、“高温”或“任意温度”)条件下能自发进行。
(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图1所示。

(已知:CH3OCH3的选择性=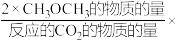 100%)
100%)
其中表示平衡时CH3OCH3的选择性的曲线是_______ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是________ ;为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为________ (填标号)。
a.高温、高压 b.低温、高压 c.高温、低压 d.低温、低压
②对于反应II的反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正-k逆________ (填“增大”、“减小”或”不变”);
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=________ 。
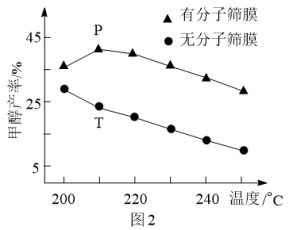
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图2所示。P点甲醇产率高于T点的原因为___________ 。
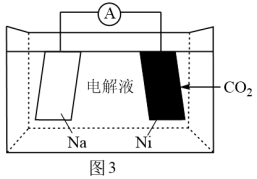
(4)CO2的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的Na-CO2电池,如图3是一种Na-CO2二次电池,其中钠和负载碳纳米管的镍网分别作为电极材料,电池放电产物为Na2CO3和C,则放电时正极电极反应式为___________ 。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH1=-159.5kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5kJ/mol
总反应III:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3
反应III的ΔH3=
(2)二甲醚(CH3OCH3)被誉为“21世纪的清洁燃料,以CO2、H2为原料制备二甲醚涉及的主要反应如下:
I.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) ΔH1=-122.5kJ/mol
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、II,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图1所示。

(已知:CH3OCH3的选择性=
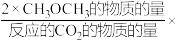 100%)
100%)其中表示平衡时CH3OCH3的选择性的曲线是
a.高温、高压 b.低温、高压 c.高温、低压 d.低温、低压
②对于反应II的反应速率v=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
a.降低温度,k正-k逆
b.在一定温度和压强下的反应II,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时,v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=
(3)用H2还原CO2可以合成CH3OH:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。恒压下,CO2和H2的起始物质的量之比为1:3时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜(能选择性分离出H2O)时甲醇的产率随温度的变化如图2所示。P点甲醇产率高于T点的原因为

(4)CO2的再利用技术是促进可持续发展的措施之一,南开大学化学学院陈军院士课题组则成功研制出新型的Na-CO2电池,如图3是一种Na-CO2二次电池,其中钠和负载碳纳米管的镍网分别作为电极材料,电池放电产物为Na2CO3和C,则放电时正极电极反应式为

您最近一年使用:0次
2022-03-29更新
|
428次组卷
|
2卷引用:辽宁省抚顺市普通高中2021-2022学年高三下学期第一次模拟考试化学试题
6 . 以CO2和甲醇(MeOH)为原料合成碳酸二甲酯(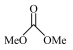 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
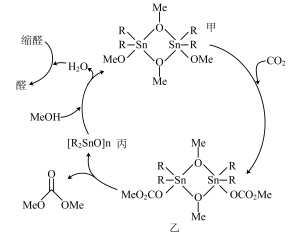
 )的催化反应机理如图所示。下列说法不正确的是
)的催化反应机理如图所示。下列说法不正确的是
A.总反应为: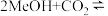 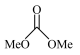 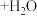 |
| B.乙是该反应的中间体 |
| C.甲→乙过程中Sn的配位数未发生改变 |
| D.加入缩醛能使总反应平衡逆向移动 |
您最近一年使用:0次



