1 . 尿素是一种适用于各种土壤和植物的有机态氮肥,是首个由无机物人工合成的有机物。以 等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与 在一定条件下反应制得
在一定条件下反应制得 。
。
①该反应的化学方程式是___________ 。
② 晶体中含有的化学键有
晶体中含有的化学键有___________ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
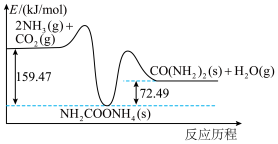
(2) 和
和 合成尿素
合成尿素 的能量变化如图所示,写出该反应的热化学方程式:
的能量变化如图所示,写出该反应的热化学方程式:___________ 。
(3)在恒容密闭容器中发生反应: ,下列能说明该反应达到平衡状态的是___________(填序号)。
,下列能说明该反应达到平衡状态的是___________(填序号)。
(4)在恒容密闭容器中发生反应: ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[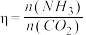 ,
,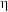 分别为1∶1、2∶1、3∶1]和温度关系如图所示。
分别为1∶1、2∶1、3∶1]和温度关系如图所示。
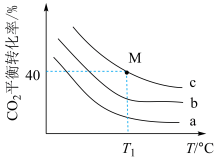
①曲线a代表的投料比为___________ ;
②若 ℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为___________ 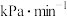 ,M点对应条件下的分压平衡常数为
,M点对应条件下的分压平衡常数为___________ 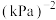 (列出计算式即可)。
(列出计算式即可)。
 等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与
 在一定条件下反应制得
在一定条件下反应制得 。
。①该反应的化学方程式是
②
 晶体中含有的化学键有
晶体中含有的化学键有A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(2)
 和
和 合成尿素
合成尿素 的能量变化如图所示,写出该反应的热化学方程式:
的能量变化如图所示,写出该反应的热化学方程式:
(3)在恒容密闭容器中发生反应:
 ,下列能说明该反应达到平衡状态的是___________(填序号)。
,下列能说明该反应达到平衡状态的是___________(填序号)。A.单位时间内每消耗44g ,同时生成18g ,同时生成18g |
| B.容器中混合气体平均摩尔质量不变 |
C.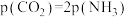 |
D. 的分压保持不变 的分压保持不变 |
(4)在恒容密闭容器中发生反应:
 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[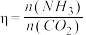 ,
,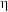 分别为1∶1、2∶1、3∶1]和温度关系如图所示。
分别为1∶1、2∶1、3∶1]和温度关系如图所示。
①曲线a代表的投料比为
②若
 ℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为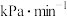 ,M点对应条件下的分压平衡常数为
,M点对应条件下的分压平衡常数为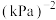 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2 . I.已知:Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H1=+akJ·mol-1
2AlC13(g) 2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
则由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________________________ 。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
回答下列问题:
(1)该反应为___________ 反应(填"吸热"或"放热")。
(2)某温度下,各物质的平衡浓度符合关系式:9c(CO2)·c(H2)=10c(CO)·c(H2O),试判断此时的温度为______________ 。
(3)830℃时,向体积为2L的密闭容器中通入1molCO2(g)和1molH2(g),下列能说明该反应达到化学平衡状态的是___________ 。(填序号)
①CO2(g)和H2(g)浓度相等;
②CO(g)的生成速率和H2O(g)消耗速率相等
③混合气体的密度不再改变;
④CO(g)体积分数不再改变;
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡___________ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
III.(1)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为______________________ 。
(2)若以该电池为电源,用石墨作电极电解200mL含有以下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为___________ mol。
2AlC13(g)
 2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)
2Al(s)+3C12(g) △H2=+bkJ·mol-1(a>b)则由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表T/℃ | 800 | 830 | 1000 | 1200 |
K | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为
(2)某温度下,各物质的平衡浓度符合关系式:9c(CO2)·c(H2)=10c(CO)·c(H2O),试判断此时的温度为
(3)830℃时,向体积为2L的密闭容器中通入1molCO2(g)和1molH2(g),下列能说明该反应达到化学平衡状态的是
①CO2(g)和H2(g)浓度相等;
②CO(g)的生成速率和H2O(g)消耗速率相等
③混合气体的密度不再改变;
④CO(g)体积分数不再改变;
(4)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡
III.(1)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为
(2)若以该电池为电源,用石墨作电极电解200mL含有以下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/mol·L-1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为
您最近一年使用:0次
2014·湖北黄冈·一模
3 . 工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5流程:

(1)步骤①所得废渣的成分是____________ (写化学式),操作I的名称__________ ;
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是_____________________________ ;
③中X试剂为(写化学式)______________________________________ ;
(3)④的离子方程式为___________________________________________ ;
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为____________ ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< _____________ ;(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有__________ 和_______________ 。

(1)步骤①所得废渣的成分是
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层) ②中萃取时必须加入适量碱,其原因是
③中X试剂为(写化学式)
(3)④的离子方程式为
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为
(5)该工艺流程中,可以循环利用的物质有
您最近一年使用:0次
2018-09-19更新
|
475次组卷
|
7卷引用:贵州省长顺县民族高级中学2018届高三下学期第一次月考理科综合化学试题
贵州省长顺县民族高级中学2018届高三下学期第一次月考理科综合化学试题(已下线)2013-2014湖北省黄冈中学高三5月模拟考试理综化学试卷(已下线)2014届湖北省黄冈中学高三5月模拟考试理综化学试卷2015届湖南省长沙市长郡中学高三第二次联考理综化学试卷2020届高三化学大二轮增分强化练——化学工艺流程题(已下线)专题讲座(八) 无机化工流程题的解题策略(精讲)-2022年一轮复习讲练测(已下线)专题讲座(八) 无机化工流程题的解题策略(讲)-2023年高考化学一轮复习讲练测(全国通用)
4 . 某化学兴趣小组为验证SO2的还原性,特邀你参与以下探究活动。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:_____________ ,你预测的理论依据是(用离子方程式表示):________________________ 。
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:_______________ 。
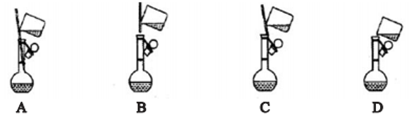
②测溶液的pH得知溶液呈酸性,其原因是:____________________ (用离子方程式表示)。
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:_______________ 。
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:_______________ 。
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:______________________ 。
I.理论预测
该兴趣小组实验实施前进行了充分的讨论交流,确定选择SO2和FeCl3溶液的反应来探究,并预测将SO2通入FeCl3溶液中的现象。小组同学想听听你的分析,你认为可能观察到的现象是:
II.实验探究
(1)配制1mol/LFeCl3溶液(未用盐酸酸化)
①下面是小组四位同学在配制溶液时的“转移”操作,其中正确的是:

②测溶液的pH得知溶液呈酸性,其原因是:
(2)SO2通入FeCl3溶液至饱和,观察到溶液由棕黄色变为红棕色,并没有观察到预期的现象。将反应后的溶液放置12小时后又出现了预期的结果。
查阅资料得知[Fe(HSO3)]2+为红棕色,生成[Fe(HSO3)]2+的反应为可逆反应。请你用化学方程式解释将SO2通入FeCl3溶液至饱和时观察到的现象:
(3)为了探究如何缩短红棕色变为预期颜色的时间,小组继续探究:另取少量FeCl3溶液,再通入SO2溶液变为红棕色,加浓HCl酸化,几分钟后变为预期颜色。
请你推测小组在实验方案设计中“加浓HCl酸化”的目的是:
III.感悟与分享
通过探究,小组同学深受启发、感悟良多。比如,有同学认为“实验才是化学的最高法庭”。请写出一种你的感悟与同学分享:
您最近一年使用:0次



