解题方法
1 . 将二氧化碳转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因此加氢制甲醇被广泛关注。在催化剂作用下主要发生以下反应。
Ⅰ.

Ⅱ.
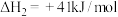
Ⅲ.

(1)反应Ⅲ自发进行的条件是______ 。
(2)恒温恒容条件下,原料气 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为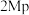 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
______ 。(对于气相反应,用组分B的平衡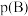 代替
代替 ,记作
,记作 。
。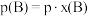 ,p为平衡压强,
,p为平衡压强,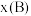 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。)
在 ,
,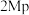 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
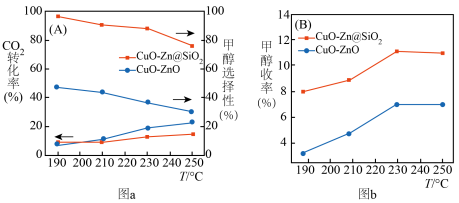
(3)分析在该压强下的最适合反应条件为______ 。
(4)推测在一定温度范围内,随着反应温度的升高, 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是______ 。
(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
(6)在 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线__________ 。
Ⅰ.


Ⅱ.

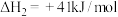
Ⅲ.


(1)反应Ⅲ自发进行的条件是
(2)恒温恒容条件下,原料气
 、
、 以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为
以物质的量浓度1:3投料时,控制合适条件(不考虑反应Ⅲ),甲醇的选择性为 。已知初始压强为
。已知初始压强为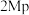 ,
, ,
, 平衡转化率为
平衡转化率为 ,则该条件下反应Ⅱ
,则该条件下反应Ⅱ
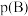 代替
代替 ,记作
,记作 。
。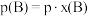 ,p为平衡压强,
,p为平衡压强,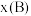 为平衡系统中
为平衡系统中 的物质的量分数。)
的物质的量分数。) 在
 ,
,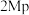 ,
, 、
、 以物质的量浓度1:3投料,以一定流速通过不同
以物质的量浓度1:3投料,以一定流速通过不同 与
与 催化剂,图a和b为催化反应
催化剂,图a和b为催化反应 转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、
转化率、甲醇选择性、甲醇收率随温度的变化,反应的产物只有甲醇、 和
和 。
。
(3)分析在该压强下的最适合反应条件为
(4)推测在一定温度范围内,随着反应温度的升高,
 转化率增大,但甲醇选择性降低的原因是
转化率增大,但甲醇选择性降低的原因是(5)催化加氢的反应机理如下图所示。

下列说法正确的是_______
A. 催化剂中 催化剂中 抑制了 抑制了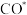 的解吸附,从而抑制 的解吸附,从而抑制 的生成。 的生成。 |
B. 催化剂上主要通过甲酸盐路径加氢生成甲醇。 催化剂上主要通过甲酸盐路径加氢生成甲醇。 |
| C.增大流速,原料气与催化剂碰撞机会多,甲醇产率一定增加。 |
D.随着温度升高,有利于 在催化剂表面反应,平衡转化率增大。 在催化剂表面反应,平衡转化率增大。 |
(6)在
 催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
催化剂条件下,保持流速与反应物投料比不变,增加反应物用量,请在图b上画出甲醇收率随温度变化曲线
您最近一年使用:0次
名校
2 . 过氧化钙(CaO2)是一种白色晶体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。通常利用CaCl2在碱性条件下与H2O2反应制得。某化学兴趣小组在实验室制备CaO2的实验方案和装置示意图(图一)如下:
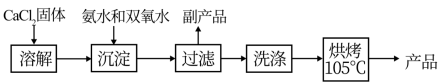
已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题
(1)仪器A的名称为___________ ,仪器C支管B的作用___________ ;
(2)加入氨水的作用是___________ ;(从化学平衡移动的原理分析)
(3)过滤后洗涤沉淀的试剂最好用__________
(4)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是___________ 、___________ (写出两种)。
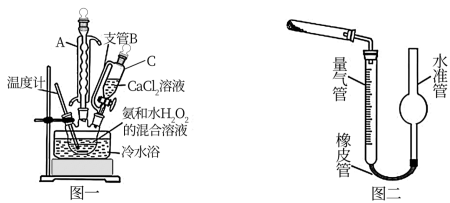
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①量气管读数的方法是:___________ ;
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为___________ (保留4位有效数字);


已知:CaO2的制备原理:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
请回答下列问题
(1)仪器A的名称为
(2)加入氨水的作用是
(3)过滤后洗涤沉淀的试剂最好用__________
| A.水 | B.浓盐酸 | C.无水乙醇 | D.CaCl2溶液 |
(5)已知CaO2在350℃时能迅速分解,生成CaO和O2。该小组采用如图二所示的装置测定刚才制备的产品中CaO2的纯度(设杂质不分解产生气体)
①量气管读数的方法是:
②准确称取0.50g样品,置于试管中加热使其完全分解,收集到44.80mL(已换算为标准状况)气体,则产品中过氧化钙的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 高纯硅被誉为“信息革命的催化剂”。某小组模拟工业上用 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
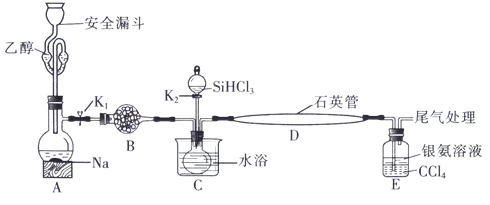
已知:① 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为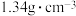 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
② ;
;
③银氨溶液中存在: 。
。
回答下列问题:
(1)装置B中试剂宜选择___________ (填字母,单选)。
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加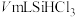 ;
;
④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为___________ (填序号)。
(3)E中CCl4的作用是防倒吸和___________ 。“防倒吸”原理是___________ 。用化学平衡原理解释银氨溶液中有白色沉淀生成:___________ 。
(4)石英管中发生反应的化学方程式为___________ 。
(5)本实验制得高纯硅ag,则SiHCl3的利用率为___________ (只列计算式)。实验结束后,有同学认为根据高纯硅与消耗钠或乙醇的量也可以计算SiHCl3的利用率,这种观点___________ (填“是”或“否”)正确。
 与
与 在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
在1357K的条件下制备高纯硅,实验装置如图所示(部分加热及夹持装置略去):
已知:①
 的沸点为33.0℃,密度为
的沸点为33.0℃,密度为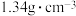 ;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;
;易溶于有机溶剂;能与水剧烈反应;在空气中易被氧化;②
 ;
;③银氨溶液中存在:
 。
。回答下列问题:
(1)装置B中试剂宜选择
a.碱石灰 b.无水氯化钙 C.五氧化二磷 d.硅胶
(2)实验操作步骤有:
①加热装置D至1357K;
②关闭K1;
③加热装置C,打开K2,滴加
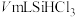 ;
;④关闭K2;
⑤打开K1,向安全漏斗中加入足量乙醇,装置A中反应一段时间。
正确的操作顺序为
(3)E中CCl4的作用是防倒吸和
(4)石英管中发生反应的化学方程式为
(5)本实验制得高纯硅ag,则SiHCl3的利用率为
您最近一年使用:0次
2021-07-04更新
|
522次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
名校
解题方法
4 . SO2随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含SO2、N2、O2、粉尘)中SO2的方法。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:
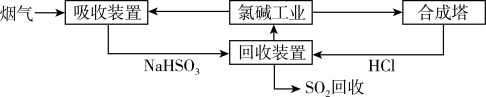
①“吸收装置”中发生反应的离子方程式是___________ 。
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是___________ 。
③上述流程中循环利用的物质是___________ 。
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是___________ (反应a)。为验证该反应,同学们将SO2通入0.05 mol·L-1 FeCl3溶液中,溶液很快由黄色变为红褐色;将溶液长时间放置后,最终变为浅绿色。
关于红褐色液体,以下是同学们的分析推测与实验。
②利用胶体的___________ (填性质)可以检验步骤ⅰ中是否得到了Fe(OH)3胶体。
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是___________ (用离子方程式及必要的文字说明)。
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用___________ (填“酸式”或“碱式”)滴定管量取试样20.00 mL,用0.10 mol·L-1 NaOH标准溶液滴定,消耗22.00 mL,该次滴定测得试样中盐酸浓度为___________ mol·L-1。
(1)方法一:利用氯碱工业产品处理含SO2的烟气,流程如下:

①“吸收装置”中发生反应的离子方程式是
②合成塔中每合成1 mol气体放出热量92.3 kJ(25 ℃、101 kPa),反应的热化学方程式是
③上述流程中循环利用的物质是
(2)方法二:利用FeCl3溶液的氧化性吸收烟气中的SO2。
①该反应的离子方程式是
关于红褐色液体,以下是同学们的分析推测与实验。
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应:Fe3++6SO2  Fe(SO2) Fe(SO2)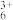 (反应b) (反应b) | ⅰ。制备Fe(OH)3胶体并检验 ⅱ。分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
③根据反应b,说明步骤ⅱ中液体颜色变化的原因是
(3)制备Cl2反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,可采用酸碱中和滴定法。用
您最近一年使用:0次
名校
5 . 某硫酸厂产生的烧渣(主要含 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
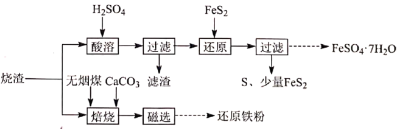
(1)“酸溶”前需粉碎烧渣,其目的是_________ 、________ 。
(2)“滤渣”的主要成分是_________ (填化学式)。
(3)“还原”时, 被氧化为
被氧化为 的离子方程式是
的离子方程式是_________ 。
(4)“焙烧”时,烧渣、无烟煤、 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
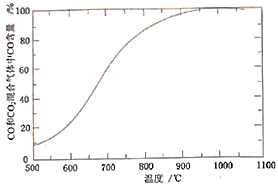
添加 的目的是:①脱除
的目的是:①脱除 等;②
等;②_________ 。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______ 。

 、
、 及少量
及少量 )可用于制备
)可用于制备 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:
(1)“酸溶”前需粉碎烧渣,其目的是
(2)“滤渣”的主要成分是
(3)“还原”时,
 被氧化为
被氧化为 的离子方程式是
的离子方程式是(4)“焙烧”时,烧渣、无烟煤、
 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
添加
 的目的是:①脱除
的目的是:①脱除 等;②
等;②(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是

您最近一年使用:0次
2020-03-14更新
|
269次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
解题方法
6 . 雾霾含有大量的污染物SO2、NO。工业上变废为宝利用工业尾气获得NH4NO3产品的流程图如下:(Ce为铈元素)

(1)上述流程中循环使用的物质有_____________________ 。
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O
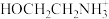 +OH-,写出乙醇胺吸收CO2的化学方程式
+OH-,写出乙醇胺吸收CO2的化学方程式___________ 。
(3)写出吸收池Ⅲ中酸性条件下NO转化为 (或NO转化为
(或NO转化为 )的离子方程式:
)的离子方程式:_____ (任选其一)。
(4)向吸收池Ⅳ得到的 溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:________________________________________ 。
(5)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是______________ 、____________ 、过滤、洗涤等。上述流程中每一步均恰好完全反应,若制得NH4NO3质量为0.8kg,电解池V制得2mol/L的 溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为________ L。

(1)上述流程中循环使用的物质有
(2)上述合成路线中用到15%~20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O

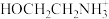 +OH-,写出乙醇胺吸收CO2的化学方程式
+OH-,写出乙醇胺吸收CO2的化学方程式(3)写出吸收池Ⅲ中酸性条件下NO转化为
 (或NO转化为
(或NO转化为 )的离子方程式:
)的离子方程式:(4)向吸收池Ⅳ得到的
 溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:(5)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是
 溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
溶液2L,则氧化池Ⅵ中消耗的O2在标准状况下的体积为
您最近一年使用:0次



